
【题目】氮氧化物是大气主要污染物,主要来自于工业废气及汽车尾气的排放,工业废气中NO是主要成分之一。
(1)乙烯作为还原剂的脱硝(NO),其反应机理示意图如图所示.写出解吸过程的化学方程式____________________。

(2)FeSO4-Na2SO3复合吸收剂吸收烟气中的NO,该方法利用Fe2+易与NO发生络合反应的特性,原理如下NO+FeSO4![]() Fe(NO)SO4
Fe(NO)SO4
①如图是一段时间内不同吸收剂对NO脱除率对比,加入Na2SO3溶液后,吸收效率增强,除了Na2SO3也能吸收部分NO外,还能防氧化从而增大Fe2+的含量,写出此原理的离子方程式_______________________________________。

②模拟实验表明,温度过高或过低都会降低NO的脱除率,其原因是_______________________________________。
(3)采用无隔膜法电解食盐水脱氮可将氮氧化物转化成NO3-,原理如图

①无隔膜条件下电解食盐水后溶液呈弱碱性,原因是____________________________.
②写出NO发生反应的离子方程式____________________________。
③根据下图所示,脱NO过程中控制溶液pH在______________范围内更合理。

【答案】2C2H4+6NO2![]() 4CO2+3N2+4H2O 2Fe3++SO32-+H2O=2Fe3++SO42-+2H+ 温度过低,反应速率缓慢;温度过高,NO的溶解度降低,都会造成脱除率下降 ClO-+H2O
4CO2+3N2+4H2O 2Fe3++SO32-+H2O=2Fe3++SO42-+2H+ 温度过低,反应速率缓慢;温度过高,NO的溶解度降低,都会造成脱除率下降 ClO-+H2O![]() HClO+OH- 2NO+3ClO-+2OH-
HClO+OH- 2NO+3ClO-+2OH-![]() 2NO3-+3Cl-+2H2O 5—6
2NO3-+3Cl-+2H2O 5—6
【解析】
(1)反应机理示意图如图所示,解吸过程反应物为C2H4,NO2生成物为CO2、N2、H2O ,写出对应化学方程式;
(2)①Na2SO3具有还原性,Fe3+具有氧化性,两者发生氧化还原反应,能防Fe2+氧化从而增大Fe2+的含量;
②温度过低,反应速率缓慢,温度过高,NO的溶解度降低;
(3)①电解食盐水,阳极失去电子,反生为2Cl--2e-=Cl2↑,阴极得到电子,反生的反应为2H2O+2e-=2OH-+H2↑,总反应方程式为Cl-+ H2O= ClO-+H2↑,ClO-会水解;
②ClO-作氧化剂,NO为还原剂,在碱性条件下的反应为2NO+3ClO-+2OH-![]() 2NO3-+3Cl-+2H2O;
2NO3-+3Cl-+2H2O;
③根据图分析,当pH介于5-6时,Cl元素以HClO存在,此时氧化性最强。
(1)反应机理示意图如图所示,解吸过程反应物为C2H4,NO2生成物为CO2、N2、H2O ,化学方程式为2C2H4+6NO2![]() 4CO2+3N2+4H2O,故答案为:2C2H4+6NO2
4CO2+3N2+4H2O,故答案为:2C2H4+6NO2![]() 4CO2+3N2+4H2O;
4CO2+3N2+4H2O;
(2) ①Na2SO3具有还原性,Fe3+具有氧化性,两者发生氧化还原反应,能防Fe2+氧化从而增大Fe2+的含量,离子方程式为2Fe3++SO32-+H2O=2Fe3++SO42-+2H+,故答案为:2Fe3++SO32-+H2O=2Fe3++SO42-+2H+;
②温度过低,反应速率缓慢,温度过高,NO的溶解度降低,故答案为:温度过低,反应速率缓慢;温度过高,NO的溶解度降低,都会造成脱除率下降;
(3)①电解食盐水,阳极失去电子,反生为2Cl--2e-=Cl2↑,阴极得到电子,反生的反应为2H2O+2e-=2OH-+H2↑,总反应方程式为Cl-+ H2O= ClO-+H2↑,ClO-会发生水解,方程式为ClO-+H2O![]() HClO+OH-,故答案为:ClO-+H2O
HClO+OH-,故答案为:ClO-+H2O![]() HClO+OH-;
HClO+OH-;
②ClO-作氧化剂,NO为还原剂,在碱性条件下的反应为2NO+3ClO-+2OH-![]() 2NO3-+3Cl-+2H2O,故答案为:2NO+3ClO-+2OH-
2NO3-+3Cl-+2H2O,故答案为:2NO+3ClO-+2OH-![]() 2NO3-+3Cl-+2H2O;
2NO3-+3Cl-+2H2O;
③根据图分析,当pH介于5-6时,Cl元素以HClO存在,此时氧化性最强,故答案为5-6。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下图是一个化学过程的示意图。
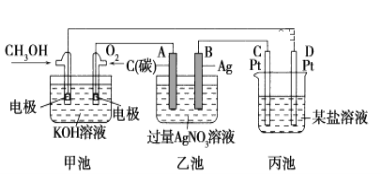
(1)图中甲池是________装置(填“电解池”或“原电池”)
(2)写出通入CH3OH的电极的电极反应式: _______________________。
(3)向乙池两电极附近分别滴加适量紫色石蕊试液,附近变红的电极为________极(填“A”或“B”),并写出此电极的电极反应式:______________。
(4)若丙中电极不变,将其溶液换成NaCl溶液,丙池中总反应的离子方程式:__________。
(5)常温下,当乙池中B(Ag)极的质量增加5.40 g时,乙池的pH是________(若此时乙池中溶液的体积为500 mL);
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.2 mol某烃A在氧气中充分燃烧后,生成化合物B、C各1.2 mol。试回答:
(1)烃A的分子式为______________。
(2)若取一定量的烃A完全燃烧后,生成B、C各3 mol,则有______g烃A参加了反应,燃烧时消耗氧气______摩尔。
(3)若烃A不能使溴水褪色,但在一定条件下,能与氯气发生取代反应,其一氯代物只有一种,则烃A的结构简式为______________。
(4)若烃A能使溴水褪色,在催化剂作用下,与H2加成,其加成产物分子中含有4个甲基,烃A可能有的结构简式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国科学家在合成氨(N2+3H2![]() 2NH3△H<0)反应机理研究中取得新进展,首次报道了LiH-3d过渡金属这一复合催化剂体系,并提出了“氮转移”催化机理。如图所示,下列说法不正确的是
2NH3△H<0)反应机理研究中取得新进展,首次报道了LiH-3d过渡金属这一复合催化剂体系,并提出了“氮转移”催化机理。如图所示,下列说法不正确的是
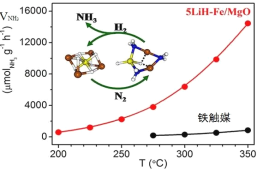
A.转化过程中有非极性键断裂与形成
B.复合催化剂降低了反应的活化能
C.复合催化剂能降低合成氨反应的焓变
D.低温下合成氨,能提高原料转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家分析,地球原始大气中的COS(羰基硫)对氨基酸缩合形成多肽的反应有催化作用,对生命起源起到重要作用。
(1)写出COS的电子式________,C与O形成共价键时,共用电子对会偏向____原子,判断依据是___________。
(2)已知 COS(g)+ H2O(g)![]() H2S(g)+ CO2(g) ΔH1 = - 34kJ/mol
H2S(g)+ CO2(g) ΔH1 = - 34kJ/mol
CO(g)+ H2O(g)![]() H2(g)+ CO2(g) ΔH2 = - 41kJ/mol
H2(g)+ CO2(g) ΔH2 = - 41kJ/mol
写出H2S与CO反应生成 COS 的热化学方程式:_________;100℃ 时将CO与H2S按物质的量比为 1:1 充入反应器中,达平衡后CO的转化率α = 33.3%,此时反应的平衡常数K =______。
(3)在充有催化剂的恒压密闭容器中进行反应。 设起始充入的 n(CO):n(H2S)=m,相同时间内测得H2S转化率与m和温度(T)的关系如图所示。

①m1________m2。(填“ > ”、“ < ”或“ = ”)
②温度高于 T0时,H2S 转化率减小的可能原因为________。
A 反应停止了
B 反应的 ΔH 变大
C 反应达到平衡
D 催化剂活性降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中有关物质的量浓度关系不正确的是
A.pH相等的NaOH、CH3COONa和NaHCO3三种溶液,则有c(NaOH)<c(CH3COONa)<c(NaHCO3)
B.已知25℃时Ksp(AgCl)=1.8×10-10,则在0.3 mol·L-1 NaCl溶液中,Ag+的物质的量浓度最大可达到6.0×10-10 mol·L-1
C.25℃时,0.1 mol·L-1 Na2CO3溶液中水电离出来的c(OH)大于0.1 mol·L-1 NaOH溶液中水电离出来的c(OH-)
D.浓度均为0.1 mol/L的CH3COOH和CH3COONa溶液等体积混合:c(CH3COO-)+2c(OH-)=c(CH2COOH)+2c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用CO和H2在催化剂的作用下合成甲醇,发生的反应如下:CO(g)+2H2(g)![]() CH3OH(g),在体积一定的密闭容器中按物质的量之比1:2充入CO和H2,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如图所示。下列说法正确的是
CH3OH(g),在体积一定的密闭容器中按物质的量之比1:2充入CO和H2,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如图所示。下列说法正确的是

A. 该反应的△H<0,且p1<p2
B. 反应速率:ν逆(状态A)>ν逆(状态B)
C. 在C点时,CO转化率为75%
D. 在恒温恒压条件下向密闭容器中充入不同量的CH3OH,达平衡时CH3OH的体积分数也不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科研工作者研发了电解熔融甲硫醇钠(CH3SNa)制备杀虫剂CH3-S-S-CH3的方法,克服了常规合成法造成的污染,并大幅度提高了原料转化率。基本原理如图所示,A、B为惰性电极,CH3-S-S-CH3在A电极产生,下列说法错误的是( )
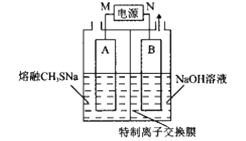
A.M极为电源的正极,B极为电解池的阴极
B.A极的电极反应:2CH3S-+2e-═CH3-S-S-CH3
C.装置中的离子交换膜为阳离子交换膜
D.该装置工作一段时间,右侧电极室中NaOH浓度减小
查看答案和解析>>
科目:高中化学 来源: 题型:
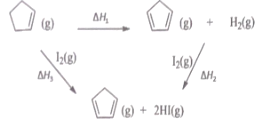
【题目】环戊二烯之(![]() ) 是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产,根据能量循环图和表格中的键能,下列说法正确的是
) 是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产,根据能量循环图和表格中的键能,下列说法正确的是
共价键 | 键能/ |
H-H | 436 |
H-I | 299 |
I-I | 151 |
A.△H1+△H2+△H3=0
B.△H1<△H3
C.![]() (g)转化为
(g)转化为![]() (g)的过程中,有C-H的断裂和形成
(g)的过程中,有C-H的断裂和形成
D.在相同条件下,生成 2molHCl(g) 的△H2′<△H2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com