
【题目】金属是重要但又匮乏的战略资源。从废旧锂电池的电极材料(主要为附在铝箔上的LiCoO2,还有少量铁的氧化物)中回收钴的一种工艺流程如下

请回答下列问题
(1)在焰色反应实验中,可用钴玻璃观察钾元素的焰色,该钴玻璃的颜色为_______。
(2)”溶液A中溶质除NaOH外,还有______。“钴渣”中LiCoO2溶解时的离子方程式为___________________________________。
(3)在“滤液”中加入20﹪Na2CO3溶液,目的是_________;检验“滤液1”中Fe2+是否完全被氧化、不能用酸性KMnO4溶液,原因是___________________________。
(4)如将硫酸改为盐酸浸取“钴渣“,也可得到Co2+。
①浸取时,为提高”钴渣”中浸取率,可采取的措施有_____________(任写一条)。
②工业生产中一般不用盐酸浸取“钴渣”,其原因是_____________________。
(5)”钴沉淀”的化学式可表示为CoCO3·yCo(OH)2。称取5.17g该样品置于硬质玻璃管中,在氮气中加热.使样品完全分解为CoO,生成的气体依次导入足量的浓硫酸和碱石灰中,二者分别增重0.54g和0.88g。则“钴沉淀”的化学式为__________。
【答案】蓝色 NaAlO2 或:偏铝酸钠 8LiCoO2+S2O32-+22H+==8Li++8Co2++2SO42-+11H2O 调节溶液pH,使Fe3+转换为Fe(OH)3沉淀 Co2+、S2O32-也能使KMnO4溶液褪色 粉碎;搅拌;升高温度 LiCoO2可氧化盐酸,产生的Cl2会污染环境 2CoCO3·3Co(OH)2
【解析】
(1)观察钾元素的焰色,黄色火焰会干扰,因此需要通过蓝色钴玻璃进行观察;
(2)电极材料中加入NaOH溶液,根据流程以及电极材料的成分,只有Al与NaOH溶液发生反应:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,溶液A中溶质除NaOH外,还有NaAlO2;Na2S2O3具有还原性,LiCoO2作氧化剂,Co被还原成Co2+,离子方程式为8LiCoO2+S2O32-+22H+=8Li++8Co2++2SO42-+11H2O;
(3)根据流程,滤液1中含有铁元素和锂元素等杂质,滤液2中除去Li+,则滤液1中加入NaClO3将Fe2+氧化成Fe3+,加入Na2CO3溶液,调节pH,使Fe3+转化成Fe(OH)3沉淀;“钴渣”操作步骤中加入Na2S2O3是过量,能使酸性高锰酸钾溶液褪色,同时滤液1中含有Co2+,也能使酸性高锰酸钾溶液褪色;
(4)①提高浸取率的采取措施有粉碎、搅拌、升高温度、适当提高硫酸的浓度等;
②Co3+的氧化性强于Cl2,用盐酸浸取,LiCoO2将盐酸中Cl元素氧化成Cl2,Cl2有毒,污染环境;
(5)根据题意,浓硫酸吸收产生H2O,即n(H2O)=0.54g/18g·mol-1=0.03mol,碱石灰的作用是吸收CO2,即n(CO2)=0.88g/44g·mol-1=0.02mol,因此有5.17g/M[CoCO3 ·yCo(OH)2]g·mol-1=0.02mol,解得y=3/2,即“钴沉淀”的化学式为2CoCO3·3Co(OH)2。


科目:高中化学 来源: 题型:
【题目】过硫酸钠(Na2S2O8)常用作漂白剂、氧化剂等。某研究小组利用下图装置制备Na2S2O8并探究其性质(加热及夹持仪器略去)。
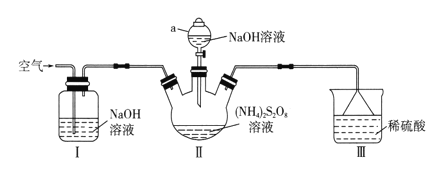
已知:①(NH4)2S2O8+2NaOH![]() Na2S2O8+2NH3+2H2O
Na2S2O8+2NH3+2H2O
②2NH3+3Na2S2O8+6NaOH![]() 6Na2SO4+N2+6H2O
6Na2SO4+N2+6H2O
(1)仪器a的名称是________________。装置I中NaOH溶液的作用是___________。
(2)装置II发生反应的同时,需要持续通入空气的目的是_______________________。
(3)装置III的作用是__________________________。
(4)Na2S2O8溶液与铜反应只生成两种盐,且反应先慢后快。
①该反应的化学方程式为___________________________。
②某同学推测反应先慢后快的原因可能是生成的Cu2+对反应起催化作用。设计实验方案验证该推测是否正确___________。(供选试剂:Cu、Na2S2O8溶液、CuSO4溶液、Cu(NO3)2溶液、蒸馏水)
(5)测定产品纯度:称取0.2500g样品,用蒸馏水溶解,加入过量KI,充分反应后,再滴加几滴指示剂,用0.1000mol/LNa2S2O8标准溶液滴定,达到滴定终点时,消耗标准溶液的体积为19.50mL。(已知:I2+2S2O32-=S4O62-+2I-)
①选用的指示剂是____________;达到滴定终点的现象是______________________。
②样品的纯度为___________%。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某反应aA(g)+bB(g)![]() cC(g)△H="Q" 在密闭容器中进行,在不同温度(T1和T2)及压强(P1和P2)下,混合气体中B的质量分数w(B)与反应时间(t)的关系如图所示,下列判断正确的是( )
cC(g)△H="Q" 在密闭容器中进行,在不同温度(T1和T2)及压强(P1和P2)下,混合气体中B的质量分数w(B)与反应时间(t)的关系如图所示,下列判断正确的是( )

A. T1<T2,P1<P2,a+b>c,Q<0
B. T1>T2,P1<P2,a+b<c,Q>0
C. T1<T2,P1>P2,a+b<c,Q>0
D. T1<T2,P1>P2,a+b>c,Q<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,向一带活塞的密闭容器中充入2molA和1molB,发生下列反应:2A(g)+B(g)![]() 2C(g) △H< 0,达到平衡后,在t1时刻改变条件,化学反应速率随时间变化如图。下列对t1时刻改变条件的推测中正确的是
2C(g) △H< 0,达到平衡后,在t1时刻改变条件,化学反应速率随时间变化如图。下列对t1时刻改变条件的推测中正确的是
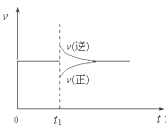
A、保持压强不变,升高反应温度
B、保持温度不变,增大容器体积
C、保持温度和容器体积不变,充入1molC(g)
D、保持温度和压强不变,充入1molC(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水合肼(N2H4H2O)是一种强还原性的碱性液体,是一种用途广泛的化工原料,实验室用如图装置制备(部分装置省略)。回答下列问题:

(1)步骤1关闭K2、K3,打开K1,制备NaClO;步骤2关闭______,打开_______,通入N2一段时间;关闭K3,打开K2,通入NH3,制备N2H4H2O。
(2)盛放碱石灰的仪器的名称为____________,碱石灰的作用_________________。
(3)步骤2中通入N2一段时间的原因是______________________。
(4)本装置中制备氨气的化学方程式是____________________________。
(5)NH3与NaClO反应生成N2H4H2O的化学方程式为______________________。
(6)已知:N2H4H2O+2I2=N2↑+4HI+H2O,实验室用碘标准溶液测定N2H4H2O粗产品的纯度。若称取N2H4H2O粗产品(其它杂质不与I2反应)2.000g,加水配成250.00mL溶液,移出25.00mL置于锥形瓶中,滴加几滴淀粉溶液,用0.3000molL-1的碘标准溶液进行滴定,碘标准溶液盛放在______(填“酸式”或“碱式”)滴定管中。达到终点的现象是___________。实验测得消耗碘标准溶液的平均体积为20.00mL,则粗产品中水合肼的质量分数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学帮助水质检测站配制480mL0.5mol·L-1NaOH溶液以备使用,请回答下列问题。
(1)配制过程中需要使用的玻璃仪器有烧杯、玻璃棒、胶头滴管、量筒、____。
(2)该同学应用托盘天平称取NaOH固体的质量为____g。
(3)使用容量瓶前需检查是否漏液,检查的方法是____,用容量瓶配制一定物质的量浓度的溶液,该容量瓶必须是___(填序号)。
A.干燥的
B.不漏液的
C.用欲配制的溶液润洗过的
(4)配制过程中,定容时俯视容量瓶的刻度线,则所配制溶液的浓度将___(填“偏高”“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“ ZEBRA”绿色电池是新型电动汽车的理想电源,结构如图所示:隔开两极的陶瓷管作钠离子导体。下列关于该电池的叙述错误的是

A. 放电时,Na+、Al3+均向负极移动
B. 放电时,Na元素被氧化
C. 充电时的阳极反应为:Ni+2C1--2e—=NiCl2
D. 该电池具有可快充、高比功率、放电持久等优点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)一定温度下有:a.盐酸 b.硫酸 c.醋酸三种酸溶液.(用序号abc填空)
①当其物质的量浓度相同时,c(H+)由大到小的顺序是__________.
②当其pH相同时,物质的量浓度由大到小的顺序为_________.将其稀释10倍后,pH由大到小的顺序为_____________
(2)某温度下,纯水中的c (H+)= 4.0×10-7 mol/L, 则此温度下纯水中的c (OH-)=______________mol/L; 若温度不变, 滴入稀NaOH溶液, 使c (OH-)= 5.0×10-6 mol/L,则溶液的c (H+)= _________________mol/L.
(3)在25℃时,100ml 1.0mol/L的盐酸与等体积1.2mol/L的氢氧化钠溶液混合, 混合后溶液的pH= _______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石油裂解气用途广泛,可用于合成各种橡胶和医药中间体。利用石油裂解气合成CR橡胶和医药中间体K的路线如图:

已知:I.氯代烃D的相对分子质量是113,氯的质量分数约为62.8%,核磁共振氢谱峰面积之比为2︰1;
Ⅱ.
(1)A的顺式异构体的结构简式为___________。D的系统名称是___________。
(2)反应②的条件是___________,依次写出①和③的反应类型:___________、___________。
(3)写出F→G过程中第一步反应的化学方程式:_________________________________。
(4)G还能与其他醇类发生反应,写出G与乙二醇发生聚合反应的化学方程式:________。
(5)写出比G多2个碳原子的同系物的所有同分异构体的结构简式:___________。
(6)已知双键上的氢原子很难发生取代反应。以A为起始原料,选用必要的无机试剂合成B__。合成路线流程图示如:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com