
【题目】“ ZEBRA”绿色电池是新型电动汽车的理想电源,结构如图所示:隔开两极的陶瓷管作钠离子导体。下列关于该电池的叙述错误的是

A. 放电时,Na+、Al3+均向负极移动
B. 放电时,Na元素被氧化
C. 充电时的阳极反应为:Ni+2C1--2e—=NiCl2
D. 该电池具有可快充、高比功率、放电持久等优点
科目:高中化学 来源: 题型:
【题目】下列说法错误的有
①化学反应除了生成新物质外,还伴随着能量的变化
②放热反应不需要加热就能发生
③需要加热才能发生的反应都是吸热反应
④化学反应放热还是吸热。决定于生成物具有的总能量和反应物具有的总能量的大小
⑤热化学方程式应注明反应时的温度与压强,如没注明则表示常温常压时的反应
⑥等量的氢气和氧气分别完全燃烧生成气态水和液态水,前者放出的热量多
⑦H2(g)+I2(g) ![]() 2HI(g) ΔH=-QkJ·mol-1表示常温常压下,在恒温密闭容器中当有1mol H2和1mol I2(g)反应生成2 mol HI时放出QkJ的热量
2HI(g) ΔH=-QkJ·mol-1表示常温常压下,在恒温密闭容器中当有1mol H2和1mol I2(g)反应生成2 mol HI时放出QkJ的热量
⑧同温同压下,H2(g)+Cl2(g)===2HCl(g)在光照条件下和点燃条件下的ΔH相同
A. 2项 B. 3项 C. 4项 D. 5项
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】世界水产养殖协会介绍了一种利用电化学原理净化鱼池中水质的方法,其原理如图所示,电极C1、C2为惰性电极,下列说法正确的是( )

A. C1极上发生还原反应
B. Y为电源的负极
C. 若有1molNO3-被还原,则有1molH+通过质子膜迁移至阴极区
D. 若有机物为葡萄糖(C6H12O6),则1mol葡萄糖被完全氧化时,理论上电极流出20mole-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属是重要但又匮乏的战略资源。从废旧锂电池的电极材料(主要为附在铝箔上的LiCoO2,还有少量铁的氧化物)中回收钴的一种工艺流程如下

请回答下列问题
(1)在焰色反应实验中,可用钴玻璃观察钾元素的焰色,该钴玻璃的颜色为_______。
(2)”溶液A中溶质除NaOH外,还有______。“钴渣”中LiCoO2溶解时的离子方程式为___________________________________。
(3)在“滤液”中加入20﹪Na2CO3溶液,目的是_________;检验“滤液1”中Fe2+是否完全被氧化、不能用酸性KMnO4溶液,原因是___________________________。
(4)如将硫酸改为盐酸浸取“钴渣“,也可得到Co2+。
①浸取时,为提高”钴渣”中浸取率,可采取的措施有_____________(任写一条)。
②工业生产中一般不用盐酸浸取“钴渣”,其原因是_____________________。
(5)”钴沉淀”的化学式可表示为CoCO3·yCo(OH)2。称取5.17g该样品置于硬质玻璃管中,在氮气中加热.使样品完全分解为CoO,生成的气体依次导入足量的浓硫酸和碱石灰中,二者分别增重0.54g和0.88g。则“钴沉淀”的化学式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种以“火法粗炼”、“电解精炼”相结合的炼制精铜工艺流程如下,已知“还原”反应中,冰铜中的Cu2S先转化为Cu2O,然后Cu2O再与Cu2S反应生成粗铜。下列叙述正确的是

A. 该炼铜工艺对环境友好,不会产生大气污染物
B. “烙烧”过程中, CuFeS2既是氧化剂又是还原剂
C. 在Cu2S”还原”为Cu的总反应中,Cu2O作催化剂
D. “电解”时,金、银等贵金属被置换出来形成阳极泥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)______mol H2O中含有的氧原子数与1.5 mol CO2中含有的氧原子数相等。
(2)将等物质的量的NH3和CH4混合,混合气体中NH3与CH4的质量比为________。
(3)要使NH3与CH4含相同数目的H原子,则NH3和CH4的物质的量之比为__________。
(4)臭氧层是地球生命的保护神,臭氧比氧气具有更强的氧化性.实验室可将氧气通过高压放电管来制取臭氧:![]()
![]()
![]()
① 若在上述反应中有30 %的氧气转化为臭氧,所得混合气的平均摩尔质量为________![]() (保留一位小数)
(保留一位小数)
②将8L氧气通过放电管后,恢复到原状况,得到气体6.5L,其中臭氧为__________L
③实验室将氧气和臭氧的混合气体0.896L (标准状况)通入盛有20.0g铜粉的反应器中,充分加热后(气态全部参加反应),粉末的质量变为21.6g,则原混合气中臭氧的体积分数为__________,该混合气体对氢气的相对密度为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应进行到一定程度时,反应物、生成物浓度均不再改变这是因为
A. 反应停止了B. 某种反应物已完全反应
C. 正反应速率和逆反应速率相等D. 反应物和生成物的物质的量相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是重要的化工原料,又可作为燃料。工业上利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO(g)+2H2 (g)![]() CH3OH(g) △H1;
CH3OH(g) △H1;
②CO2 (g)+3H2 (g)![]() CH3OH(g)+H2O(g) △H=-58kJ/mol;
CH3OH(g)+H2O(g) △H=-58kJ/mol;
③CO2 (g)+H2(g)![]() CO(g)+H2O(g) △H==+41k J/ mol。
CO(g)+H2O(g) △H==+41k J/ mol。
回答下列问题:
(1)已知反应①中相关的化学键键能数据如下表:
化学键 | H—H | C-O | C≡O | H-O | C—H |
E/(kJ·mol-1) | 436 | 343 | 1076 | 465 | x |
则x=___________。
(2)合成气组成n(H2)/n(CO+ CO2)=2.60时,体系中的CO平衡转化率(α)与温度和压强的关系如图甲所示。α(CO)值随温度升高而___________(填“增大”或“减小”),其原因是_____;图中的压强由大到小为___________,其判断理由是_____________。

(3)若将1mol CO2和2molH2充入容积为2L的恒容密闭容器中,在两种不同温度下发生反应②。测得CH3OH的物质的量随时间的变化如图所示。

①曲线I、Ⅱ对应的平衡常数大小关系为K1___________KⅡ(填“>”“=”或“<”)。
②一定温度下,下列能判断该反应达到化学平衡状态的是___________(填序号)。
a.容器中压强不变 b.甲醇和水蒸气的体积比保持不变
c.v正(H2)=3v逆(CH3OH) d.2个C=0断裂的同时有6个H-H断裂
③若5min后反应达到平衡状态,H2的转化率为90%,则用CO2表示的平均反应速率为____,该温度下的平衡常数为___________;若容器容积不变,下列措施可增加甲醇产率的是___________。(填序号)。
a.缩小反应容器的容积 b.使用合适的催化剂
c.充入He d.按原比例再充入CO2和H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:
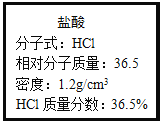
(1)该浓盐酸的物质的量浓度为___。
(2)取用任意体积的该盐酸溶液时,下列物理量中不随所取体积的多少而变化的是___。
A.溶液中HCl的物质的量 B.溶液的浓度
C.溶液中Cl-的数目 D.溶液的密度
(3)某学生欲用上述浓盐酸和蒸馏水配制450mL物质的量浓度为0.3mol/L稀盐酸。
①该学生需要量取____mL上述浓盐酸进行配制。
②配制时,其正确的操作顺序是(用字母表示,每个字母只能用一次)___;
A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶,振荡
B.用量筒准确量取所需浓盐酸的体积,慢慢沿杯壁注入盛有少量水(约30mL)的烧杯中,用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入500mL的容量瓶中
D.将容量瓶盖紧,颠倒摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度线相切
F.继续往容量瓶内小心加水,直到液面接近刻度线1~2cm处
③在配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有何影响?(填“偏高”或“偏低”或“无影响”)。
I、用量筒量取浓盐酸时俯视观察凹液面____
II、溶液注入容量瓶前没有恢复到室温就进行定容___
(4)若在标准状况下,将VLHCl气体溶于1L水中,所得溶液密度为dg/mL,则此溶液的物质的量浓度为___mol·L-1(填字母)
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com