
【题目】一种以“火法粗炼”、“电解精炼”相结合的炼制精铜工艺流程如下,已知“还原”反应中,冰铜中的Cu2S先转化为Cu2O,然后Cu2O再与Cu2S反应生成粗铜。下列叙述正确的是

A. 该炼铜工艺对环境友好,不会产生大气污染物
B. “烙烧”过程中, CuFeS2既是氧化剂又是还原剂
C. 在Cu2S”还原”为Cu的总反应中,Cu2O作催化剂
D. “电解”时,金、银等贵金属被置换出来形成阳极泥
【答案】B
【解析】
A、根据流程,冰铜得到粗铜过程中发生的反应是2Cu2S+3O2![]() 2Cu2O+2SO2、2Cu2O+Cu2S
2Cu2O+2SO2、2Cu2O+Cu2S![]() 6Cu+SO2↑,SO2能引起酸雨,属于大气污染物,该工艺对环境不友好,故A说法错误;
6Cu+SO2↑,SO2能引起酸雨,属于大气污染物,该工艺对环境不友好,故A说法错误;
B、焙烧中发生2CuFeS2+O2![]() Cu2S+2FeS+SO2,CuFeS2中S的价态为-2价,Fe的基态为+2价,Cu的价态为+2价,在反应中部分S的价态升高,Cu的价态降低,因此CuFeS2在该反应中既是氧化剂又是还原剂,故B说法正确;
Cu2S+2FeS+SO2,CuFeS2中S的价态为-2价,Fe的基态为+2价,Cu的价态为+2价,在反应中部分S的价态升高,Cu的价态降低,因此CuFeS2在该反应中既是氧化剂又是还原剂,故B说法正确;
C、根据催化剂的定义,以及A选项分析,Cu2O不是催化剂,故C说法错误;
D、粗铜中金、银以单质的形式存在,没有发生反应,金、银最终以单质的形式在阳极沉积出来,故D说法错误。


科目:高中化学 来源: 题型:
【题目】在3个体积均为1 L的恒容密闭容器中发生反应:SO2(g)+2NO(g)![]() 2NO2(g)+S(s)。改变容器I的反应温度,平衡时c( NO2)与温度的关系如下图所示。下列说法正确的是
2NO2(g)+S(s)。改变容器I的反应温度,平衡时c( NO2)与温度的关系如下图所示。下列说法正确的是


A. 该反应的ΔH<0
B. T1时,该反应的平衡常数为![]()
C. 容器Ⅰ与容器Ⅱ均在T1时达到平衡,总压强之比小于1:2
D. 若T2<T1,达到平衡时,容器Ⅲ中NO的体积分数小于40%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】香蕉果实成熟过程中由于储存的物质变为可溶性糖从而使果实甜度增加。某兴趣小组对此生理变化进行了初步探究:取未成熟香蕉果实若干放在适宜条件下让其自然成熟,每天定时取10 g果肉研磨配制成100 mL待测样液平分为A、B两份,分别用碘液和斐林试剂检测,记录颜色深浅的变化。
(1)样液A用碘液检测的目的是__________________;样液B用斐林试剂检测的目的是___________。
(2)斐林试剂使用时需甲、乙液等量混合均匀后再注入,并____________观察颜色变化。
(3)根据预期结果在坐标图中画出两种颜色的变化。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水合肼(N2H4H2O)是一种强还原性的碱性液体,是一种用途广泛的化工原料,实验室用如图装置制备(部分装置省略)。回答下列问题:

(1)步骤1关闭K2、K3,打开K1,制备NaClO;步骤2关闭______,打开_______,通入N2一段时间;关闭K3,打开K2,通入NH3,制备N2H4H2O。
(2)盛放碱石灰的仪器的名称为____________,碱石灰的作用_________________。
(3)步骤2中通入N2一段时间的原因是______________________。
(4)本装置中制备氨气的化学方程式是____________________________。
(5)NH3与NaClO反应生成N2H4H2O的化学方程式为______________________。
(6)已知:N2H4H2O+2I2=N2↑+4HI+H2O,实验室用碘标准溶液测定N2H4H2O粗产品的纯度。若称取N2H4H2O粗产品(其它杂质不与I2反应)2.000g,加水配成250.00mL溶液,移出25.00mL置于锥形瓶中,滴加几滴淀粉溶液,用0.3000molL-1的碘标准溶液进行滴定,碘标准溶液盛放在______(填“酸式”或“碱式”)滴定管中。达到终点的现象是___________。实验测得消耗碘标准溶液的平均体积为20.00mL,则粗产品中水合肼的质量分数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某可逆反应:mA(g)+nB(g) ![]() pC(g) △H 在密闭容器中进行,如图所示,反应在不同时间t,温度T和压强P与反应物B在混合气体中的百分含量(B%)的关系曲线,由曲线分析下列判断正确的是( )
pC(g) △H 在密闭容器中进行,如图所示,反应在不同时间t,温度T和压强P与反应物B在混合气体中的百分含量(B%)的关系曲线,由曲线分析下列判断正确的是( )

A. T1<T2,P1>P2,m+n>p,△H>0
B. T1>T2,P1<P2,m+n>p,△H>0
C. T1>T2,P1<P2,m+n<p,△H<0
D. T1>T2,P1>P2,m+n>p,△H>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“ ZEBRA”绿色电池是新型电动汽车的理想电源,结构如图所示:隔开两极的陶瓷管作钠离子导体。下列关于该电池的叙述错误的是

A. 放电时,Na+、Al3+均向负极移动
B. 放电时,Na元素被氧化
C. 充电时的阳极反应为:Ni+2C1--2e—=NiCl2
D. 该电池具有可快充、高比功率、放电持久等优点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一桥连三地,天堑变通途。举世瞩目的港珠澳大桥于2018年10月23日正式通车,体现了我国工程建设自主创新能力实现大跨越,尤其在新材料研究方面有重大突破,回答下列问题:
(1)钛是一种新兴的结构材料,比钢轻、比铝硬。
①基态钛原子的价电子排布式为______,与钛同周期的元素中,基态原子的未成对电子数与钛相同的有_____种
②钛的硬度比铝大的原因是_______________________________。
③工业上制金属钛采用金属还原四氧化钛。先将TiO2和足量炭粉混合加热至1000~1100K进行氯化处理,生成TiCl4。该反应的化学反应方程式为_______________________。
(2)跨海桥梁的主要结构材料为钢铁。铁能与三氮唑(Bipy,结构见图)形成多种配合物。

①1mol Bipy中所含![]() 键_____mol;碳原子杂化方式是___________________。
键_____mol;碳原子杂化方式是___________________。
②Bipy的沸点为260℃、结构相似且相対分子质量接近的环戊二烯(结构见上图)的沸点为42.5℃.前者较大的原因是______________________________。
(3)碳化钨是耐高温耐磨材料。下图为化晶体的部分结构,碳原子嵌入金属的晶格间隙,并不破坏原有金属的晶格,形成填隙+固溶体、也称为填隙化合物。

①在该结构中,每个钨原子周围距离钨原子最近的碳原子有____个。
②假设该部分晶体的体积为d/cm3,碳化的摩尔质量为Mg/mol,密度为dg/cm3,则阿伏加德罗常数NA用上述数据表示为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器发生下列反应:aA(g)![]() cC(g)+dD(g),反应达到平衡后,将容器体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是
cC(g)+dD(g),反应达到平衡后,将容器体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是
A. 平衡向正反应方向移动
B. a<c+d
C. D的体积分数增大
D. A的转化率变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,H2(g)+CO2(g)![]() H2O(g)+CO(g)的平衡常数K=9/4。该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如下表所示。下列判断不正确的是
H2O(g)+CO(g)的平衡常数K=9/4。该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如下表所示。下列判断不正确的是
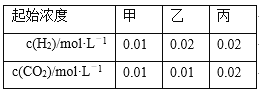
A. 反应开始时,丙中的反应速率最快,甲中的反应速率最慢
B. 平衡时,甲中和丙中H2的转化率均是60%
C. 平衡时,丙中c(CO2)是甲中的2倍,是0.012 mol·L-1
D. 平衡时,乙中CO2的转化率大于60%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com