
| A、2mol SO2和足量O2反应,必定生成2mol SO3 |
| B、该反应在容积不变的密闭容器中,若混合气的密度不变,说明达到平衡状态 |
| C、平衡时,SO2消耗速率必定等于O2生成速率的两倍 |
| D、平衡时,SO2浓度必定等于O2浓度的两倍 |


科目:高中化学 来源: 题型:
| A、用大理石跟稀盐酸制二氧化碳:CO32-+2H+═H2O+CO2↑ |
| B、向氢氧化钡溶液中加硫酸溶液:SO42-+Ba2+=BaSO4↓ |
| C、硫酸溶液中加入Mg(OH)2:2H++Mg(OH)2═Mg2++2H2O |
| D、铁与稀盐酸反应:Fe+6H+═2Fe3++3H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、自然界不存在Mg单质,C元素至少存在石墨和金刚石两种单质 |
| B、CO可以还原氧化铜,Mg能还原CO2,反应类型均为置换反应 |
| C、电解熔融氯化镁可制备Mg单质和氯气,卤水可用于提取氯化镁 |
| D、煤与水蒸气高温反应生成水煤气,其主要成分是CO和H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
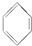 ④CH3CH3.
④CH3CH3.| A、①②③④ | B、③④ |
| C、①②④ | D、①② |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碳酸镁与H2SO4反应:MgCO3+2H+=Mg2++H2O+CO2↑ |
| B、向硝酸银溶液中加盐酸:Ag++Cl-=AgCl↓ |
| C、铁与稀硫酸反应:2Fe+6H+=2Fe3++3H2↑ |
| D、澄清石灰水与盐酸的反应:H++OH-=H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、+4 | B、+3 | C、+2 | D、+1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(H+)随着温度的升高而降低 |
| B、35℃时,c(H+)<c(OH-) |
| C、35℃时的水比25℃时的水电离程度小 |
| D、水的电离是吸热的 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙酸乙酯(乙酸):加入NaOH溶液加热,分液 |
| B、苯(苯酚):溴水,过滤 |
| C、福尔马林(甲酸):加入Na2CO3溶液,分液 |
| D、苯(苯酚):加入NaOH溶液,分液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com