
| ||
| ||
| ||
| ||
| ||
| ||
| ||
| ||
| ||
| ||
 氧化剂是Fe2O3,还原剂是CO,
氧化剂是Fe2O3,还原剂是CO, ;Fe2O3;CO.
;Fe2O3;CO.


科目:高中化学 来源: 题型:
| A、属烃类化合物 |
| B、常温下是气态 |
| C、可发生加成反应 |
| D、可发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | M | N | R |
| 初始浓度/mol?L-1 | 0.20 | 0.30 | 0 |
| 平衡浓度/mol?L-1 | 0.02 | 0.21 | 0.18 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
| 加热 |
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/×10-4mol?L-1 | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
| c(CO)/×10-3mol?L-1 | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |

查看答案和解析>>
科目:高中化学 来源: 题型:
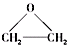 ),该反应的原子利用率为100%,反应的化学方程式为
),该反应的原子利用率为100%,反应的化学方程式为查看答案和解析>>
科目:高中化学 来源: 题型:
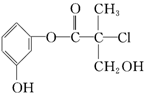 某有机物是药物生产的中间体,其结构简式如图.下列有关叙述正确的是( )
某有机物是药物生产的中间体,其结构简式如图.下列有关叙述正确的是( )| A、该有机物能与溴水发生加成反应 |
| B、该有机物与浓硫酸混合加热可发生消去反应 |
| C、1mol该有机物与足量NaOH溶液反应最多消耗3mol NaOH |
| D、该有机物经催化氧化后能发生银镜反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com