
| 消耗量 |
| 起始量 |
| 0.1×0.1 |
| 0.1×0.1 |
| x2 |
| (0.3-x)(0.2-x) |
| 0.12mol/L |
| 0.3mol/L |
| 0.12mol/L |
| 0.2mol/L |


科目:高中化学 来源: 题型:
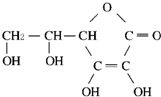 维生素C的结构如图所示,下列叙述中错误的是( )
维生素C的结构如图所示,下列叙述中错误的是( )| A、维生素C的分子式为C6H8O4 |
| B、维生素C高温时不稳定,所以生吃蔬菜水果比熟吃维生素C的损失少 |
| C、维生素C能发生加成反应 |
| D、维生素C添加到食品中既可以作防腐剂也可以作营养强化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溶液中含有1mol NaCl |
| B、1L溶液中含有58.5g NaCl |
| C、1mol NaCl溶于1L水中 |
| D、58.5g NaCl溶于941.5g水中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、蛋白质中加Na2SO4后析出蛋白质 |
| B、蛋白质用福尔马林浸泡 |
| C、蛋白质中加Pb(Ac)2后析出蛋白质固体 |
| D、蛋白质中遇X光后 |
查看答案和解析>>
科目:高中化学 来源: 题型:
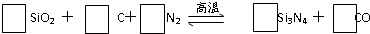
查看答案和解析>>
科目:高中化学 来源: 题型:
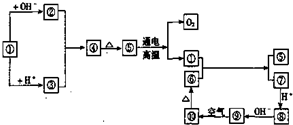
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com