
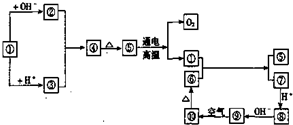
| ||
| 冰晶石 |
| ||
| ||
| 冰晶石 |
| ||


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、明矾和漂白粉常用于自来水净化和杀菌消毒,其作用原理相同 |
| B、Cl2和SO2的漂白原理不同,混合使用效果更好 |
| C、汽车尾气的大量排放不仅会造成酸雨还可能引起光化学烟雾 |
| D、可用浓盐酸酸化的高锰酸钾溶液与过氧化氢反应,证明过氧化氢具有还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、棕红色NO2加压后颜色先变深后变浅 |
| B、冰镇啤酒打开瓶塞后产生大量泡沫 |
| C、在H2,I2(g)和HI组成的平衡体系中加压后,混合物颜色加深 |
| D、Fe(SCN)3溶液中加入固体KSCN后颜色变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | M | N | R |
| 初始浓度/mol?L-1 | 0.20 | 0.30 | 0 |
| 平衡浓度/mol?L-1 | 0.02 | 0.21 | 0.18 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
| 加热 |
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/×10-4mol?L-1 | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
| c(CO)/×10-3mol?L-1 | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com