
| A、③ | B、②③④ |
| C、①③ | D、①②③④ |
| V |
| Vm |
| n |
| c |
| 2.04g |
| 17g/mol |
|
| 2.24L |
| 22.4L/mol |
| 0.02mol |
| 0.1mol |
| 1.28mol |
| 2mol/L |


 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案 黄冈创优卷系列答案
黄冈创优卷系列答案科目:高中化学 来源: 题型:
 将一定质量的镁和铝混合物投入200mL硫酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量n与加入NaOH溶液的体积V的变化如图.则下列说法不正确的是( )
将一定质量的镁和铝混合物投入200mL硫酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量n与加入NaOH溶液的体积V的变化如图.则下列说法不正确的是( )| A、最初20mL NaOH溶液用于中和过量的硫酸 |
| B、原硫酸溶液的物质的量浓度为5 mol/L |
| C、200-240 mL过程中:溶液中只发生Al(OH)3+OH-═AlO2-+2H2O |
| D、生成的氢气在标准状况下的体积为11.2 L |
查看答案和解析>>
科目:高中化学 来源: 题型:
 在t℃时,AgBr在水中的沉淀溶解平衡曲线如图所示.又知t℃时,AgCl的Ksp=4×10-10,下列说法不正确的是( )
在t℃时,AgBr在水中的沉淀溶解平衡曲线如图所示.又知t℃时,AgCl的Ksp=4×10-10,下列说法不正确的是( )| A、在t℃时,AgBr的Ksp为4.9×10-13 |
| B、图中b点对应的是向AgBr饱和溶液中加入NaBr固体后的溶液 |
| C、图中a点对应的是AgBr的不饱和溶液 |
| D、AgCl沉淀能较容易转化为AgBr沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、称量一定质量NaCl固体时,没有用烧杯,直接放在右盘的滤纸上 |
| B、加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42ˉ |
| C、蒸发时,待水分完全蒸干后才能停止加热 |
| D、加入硝酸酸化的硝酸钡溶液既无沉淀又无气体产生,再加入硝酸银溶液,立刻产生白色沉淀,一定有Clˉ |
查看答案和解析>>
科目:高中化学 来源: 题型:
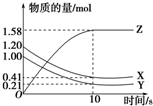 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示,下列描述正确的是( )
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示,下列描述正确的是( )| A、反应开始到10s,用Z表示的反应速率为0.158mol/(L?s) |
| B、反应开始到10s,X的物质的量浓度减少了0.79mol/L |
| C、达平衡时Y的物质的量分数为:9.5% |
| D、反应的化学方程式为:X(g)+Y(g)?Z(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用Ba(NO3)2溶液鉴别Cl-,CO32-和SO42- |
| B、稀释浓硫酸时,应将浓硫酸沿玻璃棒注入蒸馏水中 |
| C、用玻璃棒蘸取溶液,点在湿润的pH试纸上测定某溶液pH |
| D、检验某溶液中是否含有SO42-时,应取少量该溶液,依次加入氯化钡溶液和稀盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、④②①③ | B、①④③② |
| C、①③④② | D、④①③② |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com