
用18 mol·L-1 浓硫酸配制100 mL 3.0 mol·L-1 稀硫酸的实验步骤如下:
①计算所用浓硫酸的体积 ②量取一定体积的浓硫酸 ③溶解 ④
⑤转移、洗涤 ⑥定容、摇匀 ⑦装瓶贴标签
完成下列问题:
(1)所需浓硫酸的体积是 ,量取浓硫酸所用的量筒的规格是 (从下列中选用A.10 mL B.25 mL C.50 mL D.100 mL
(2)第③步实验的操作是
。
(3)下列情况对所配制的稀硫酸浓度有何影响?(用“偏大”“偏小”“无影响”填写)
A.所用的浓硫酸长时间放置在密封不好的容器中_______________________;
B.容量瓶用蒸馏水洗涤后残留有少量的水________________;
C.所用过的烧杯、玻璃棒未洗涤________________;
D.定容时俯视刻度线________________。
科目:高中化学 来源: 题型:
有一种锂电池,用金属锂和石墨作电极材料,电解质溶液是由四氯铝锂溶解在亚硫酰氯(SOCl2)中形成,电池的总反应式为8Li+3SOCl2=6LiCl+Li2SO3+2S,则下列叙述正确的是 ( )
A.用该电池电解CuCl2溶液产生2.24LCl2时,有0.2mol电子转移
B.金属锂作电池的负极,石墨作电池的正极,加入硫酸可提高电解质的导电性
C.电池工作(放电)过程中,SOCl2被还原为Li2SO3
D.电池工作过程中,负极消耗的锂与正极生成的硫质量之比为7:8
查看答案和解析>>
科目:高中化学 来源: 题型:
将标准状况下的aL HCl(g)溶于1000g水中,得到的盐酸密度为b g·cm-3,则该盐酸的物质的量浓度是 ( )
A.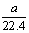 mo1·L-1 B.
mo1·L-1 B.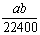 mol·L-1 C.
mol·L-1 C.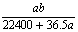 mol·L-1 D.
mol·L-1 D.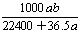 mol·L-1
mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
阿伏加德罗常数的值为6.02×1023mol-1,下列叙述中错误的是:
①12.4g 白磷晶体中含有的P-P键数是0.6×6.02×1023
②含0.2mol H2SO4的浓硫酸与足量铜反应,生成SO2的分子数为0. 1×6.02×1023
③7.8g Na2S和Na2O2的混合物中含有的阴离子数大于0.1×6.02×1023
④2mol SO2和1mol O2在V2O5存在的条件下于密闭容器中加热反应后,容器内物质分子数等于2×6.02×1023
⑤2.9g 2CaSO4•H2O含有的结晶水分子数为0.02×6.02×1023
A.①②③④⑤ B. ①③④⑤ C. ②③④⑤ D. ③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
在一密闭容器中充入一定量的N2和O2,在电火花作用下发生反应N2+O2===2NO,经测定前3 s用N2表示的反应速率为0.1 mol·L-1·s-1,则6 s末NO的浓度为
A.1.2 mol·L-1 B.大于1.2 mol·L-1
C.小于1.2 mol·L-1 D.不能确定
查看答案和解析>>
科目:高中化学 来源: 题型:
LiPF6是锂离子电池中广泛应用的电解质。某工厂用LiF、PCl5为原料,低温反应制备LiPF6,其流程如下:

已知:HCl的沸点是-85.0 ℃,HF的沸点是19.5 ℃。
(1)第①步反应中无水HF的作用是________________、________________。反应设备不能用玻璃材质的原因是______________________________________________(用化学方程式表示)。无水HF有腐蚀性和毒性,工厂安全手册提示:如果不小心将HF沾到皮肤上,可立即用2%的________溶液冲洗。
(2)该流程需在无水条件下进行,第③步反应中PF5极易水解,其产物为两种酸,写出PF5水解的化学方程式:____________________________________。
(3)第④步分离采用的方法是________;第⑤步分离尾气中HF、HCl采用的方法是________。
(4)LiPF6产品中通常混有少量LiF。取样品w g,测得Li的物质的量为n mol,则该样品中LiPF6的物质的量为________mol(用含w、n的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com