
【题目】氮氧化物是造成酸雨、臭氧空洞、光化学烟雾等环境问题的主要原因之一。如何消除大气污染物中氮氧化物已成为人们关注的主要问题之一。
I.NH3-SCR法是工业上消除氮氧化物的常用方法。该法是利用氨的还原性,在一定条件下,将烟气中的NOx直接还原为N2。
主要反应原理为:4NH3+4NO+O2![]() 4N2+6H2O
4N2+6H2O
(1)已知有下列热化学方程式:
①4NH3(g)+4NO(g)+O2(g)![]() 4N2(g)+6H2O(1) △H =-1891.5kJmol-1
4N2(g)+6H2O(1) △H =-1891.5kJmol-1
②N2(g)+O2(g)![]() 2NO(g) △H =+180.5kJmol-1
2NO(g) △H =+180.5kJmol-1
③H2O(1)=H2O(g) △H =+44.0kJmol-1
则氨气与氧气反应生成NO和气态水的热化学方程式为_________________________________。
(2)其他条件相同,某2 L密闭容器中分别投入2 mol NH3、2 mol NO、1 mol O2,在甲、乙两种催化剂作用下,NO转化率与温度的关系如图所示。
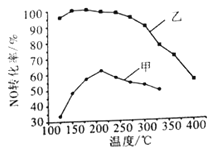
①工业上选择催化剂乙的原因是_________________。
②在催化剂甲作用下,高于210℃时,NO转化率降低的原因可能是_______________________。
Ⅱ.CH4可以消除氮氧化物的污染。主要反应原理为:CH4(g)+2NO2(g)= CO2(g)+2H2O(g)+ N2(g) △H=-868.7kJmol-1
(3)在3.00L密闭容器中,通入0.100mol CH4和0.200mol NO2,在一定温度下进行上述反应,反应时间(t)与容器内气体总压强(P) 的数据见下表:
反应时间t/min | 0 | 2 | 4 | 6 | 8 | 10 |
总压强P/100kPa | 4.80 | 5.44 | 5.76 | 5.92 | 6.00 | 6.00 |
由表中数据,计算0-4min内v(NO2)=____________,该温度下的平衡常数K=________________。
(4)在一恒容装置中,通入一定量CH4和NO2,测得在相同时间内和不同温度下,NO2的转化率α(NO2)如下图,则下列叙述正确的是_____________
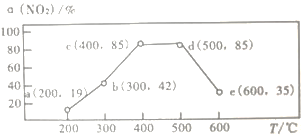
A.若温度维持在200℃更长时间,NO2的转化率将大于19%
B.反应速率:b点的v(逆)>e点的v(逆)
C.平衡常数: c点=d点
D.在时间t内,提高c点时NO2的转化率和反应速率,可适当升温或增大c(CH4)
Ⅲ.工业上也常采用电解的方法消除氮氧化物的污染。
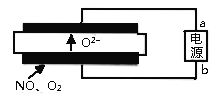
(5)清华大学曹天宇等人研究的基于固体氧化物电解池(SOEC)
【答案】 4NH3(g)+5O2(g)=4NO(g)+6H2O(g) ΔH=- 905.5kJ·mol-1 低温下有很强的催化活性(或在较大的温度范围内有较高催化活性) 温度超出了催化剂的活性温度范围;温度升高发生了副反应,该反应是放热反应,达到平衡后升高温度,平衡逆向移动等 0.0100mol·L-l·min-1 0.675mol·L-1 AD 正 2NO+4e-=N2+2O2- O2+4e-=2O2-
【解析】(1)①+4×②+6×③得到:4NH3(g) + 5O2(g) = 4NO(g) + 6H2O(g) ΔH=- 905.5kJ·mol-1。
(2)①从图中看出,乙催化剂在较低温度下就可以达到较好的催化效果,所以工业上会使用乙催化剂。
②当温度高于210℃的时候,在催化剂甲的作用下,NO的转化率降低,其原因可能是:在较高温度下,催化剂的催化活性降低,反应的NO减少,转化率降低;也可能是反应已经达平衡,升高温度平衡逆向移动,转化率降低;另外一种可能性是,温度升高,发生副反应,所以转化率降低。
(3)恒温恒容下,容器的压强比等于气体的物质的量的比。
CH4(g) + 2NO2(g) = CO2(g) + 2H2O(g) + N2(g)
起始: 0.100 0.200 0 0 0
反应: X 2X X 2X X
4min: 0.100-X 0.200-2X X 2X X
所以起始有0.3mol气体,4min时有(0.3+X) mol气体,有0.3∶(0.3+X)=4.80∶5.76,解得X=0.0600。所以反应的NO2为0.120mol,速率为:0.120mol÷3L÷4min=0.0100mol·L-l·min-1。
达到平衡时的压强为6.00,所以有:
CH4(g) + 2NO2(g) = CO2(g) + 2H2O(g) + N2(g)
起始: 0.100 0.200 0 0 0
反应: X 2X X 2X X
平衡: 0.100-X 0.200-2X X 2X X
所以起始有0.3mol气体,平衡时有(0.3+X) mol气体,有0.3∶(0.3+X)=4.80∶6,解得X=0.075。所以达平衡时CH4、NO2、CO2、H2O、N2的物质的量分别为0.025mol、0.05mol、0.075mol、0.15mol、0.075mol;平衡常数K=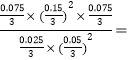 0.675mol·L-1。
0.675mol·L-1。
(4)实验的测定过程为:在一恒容装置中,通入一定量CH4和NO2,测在相同时间内和不同温度下,NO2的转化率α(NO2)。所以实验中测得的是不同温度下,反应相同时间后,NO2的转化率,不一定是平衡转化率。所以温度较低的时候,反应较慢,此时间没有达平衡,那么反应速率较快的,反应的NO2多,转化率就高(a、b、c三点符合此要求);温度较高时,反应快,此时间达到平衡态,则温度升高平衡逆向移动,转化率降低(d、e两点符合此要求)。由上,a点(200℃,转化率为19%)未达平衡,则如果反应时间再长一些,反应的NO2就会增加,转化率会高于19%,选项A正确。e点的温度高于b点所以速率应该高于b点,选项B错误。点c和点d的温度不等,则平衡常数一定不等,选项C错误。点c未达平衡,所以在不改变反应时间的前提下,升高温度加快反应速率,在相同时间内反应更多的NO2,提高NO2的转化率;增大甲烷的浓度一定加快速率,平衡正向移动,提高NO2的转化率,选项D正确。所以答案为AD。
(5)电解时阴离子应该向正极移动,根据图示的O2-的移动方向,确定上面是电解的阳极,所以a是电源的正极。阴极的反应物是NO、O2,从图中得到,阴极应该生成O2-,所以反应为(该装置是去污染装置,所以NO应该转化为氮气):2NO+4e-=N2+2O2-;O2+4e-=2O2-。


 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案科目:高中化学 来源: 题型:
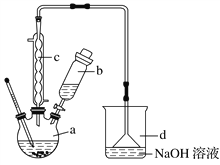
【题目】溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:
苯 | 溴 | 溴苯 | |
密度/g·cm-3 | 0.88 | 3.10 | 1.50 |
沸点/℃ | 80 | 59 | 156 |
水中溶解度 | 微溶 | 微溶 | 微溶 |
按下列合成步骤回答问题:
(1)在a中加入15 mL无水苯和少量铁屑。在b中小心加入4.0 mL液态溴。向a中滴入几滴溴,有白色烟雾产生,是因为生成了________气体;继续滴加至液溴滴完;装置d的作用是________________。
(2)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10 mL水,然后过滤除去未反应的铁屑;
②滤液依次用10 mL水、8 mL 10%的NaOH溶液、10 mL水洗涤。NaOH溶液洗涤的作用是_______________________________________________________;
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤。加入氯化钙的目的是____________________________________________ 。
(3)经以上分离操作后,粗溴苯中还含有的主要杂质为______,要进一步提纯,下列操作中可行的是________(填字母)。
A.重结晶 B.过滤
C.蒸馏 D.萃取
(4)在该实验中,a的容积最适合的是________(填字母)。
A.25 mL B.50 mL
C.250 mL D.500 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质在水溶液中的电离方程式错误的是
A. CH3COOH=H+ +CH3COO- B. Ba(OH)2=Ba2++2OH-
C. KHSO4=K++H++SO42- D. MgCl2=Mg2++2Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列四个图象的说法中不正确的是
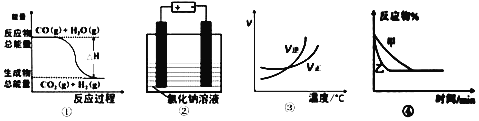
A. 图①可表示可逆反应:CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH<0
CO2(g)+H2(g) ΔH<0
B. 图②表示用惰性电极电解足量氯化钠溶液时,两极产生的气体物质的量相等
C. 图③可表示可逆反应:A2(g)+3B2(g)![]() 2AB3(g) ΔH >0
2AB3(g) ΔH >0
D. 图④可表示压强对可逆反应:2A(g)+B(g)![]() 3C(g)+D(s)的影响,且乙压强大
3C(g)+D(s)的影响,且乙压强大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实与盐类水解无关的是
A. 热的纯碱溶液去污能力增强 B. NaHSO4溶液显酸性
C. 明矾用作净水剂 D. 泡沫灭火器使用中产生大量泡沫
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学实验是进行化学研究的有效方法,请回答下列实验中的有关问题。
I.用如图所示的装置测定中和热。

实验药品:100mL 0.50 molL-1盐酸、100mL 0.55 molL-1NaOH溶液。
实验步骤:略。
回答下列问题:
(1)从实验装置上看,还缺少环形玻璃搅拌棒,该装置的作用是____________;有同学提议可以用铜质搅拌棒替代,你是否赞同(说明理由)________________。
(2)你认为该实验成功的关键是______________________________。
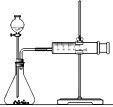
II.影响化学反应速率的因素很多,某校课外兴趣小组用实验的方法进行探究。甲、乙两个兴趣小组利用Mg、Fe、Cu和不同浓度的硫酸(0.5 molL-1、2 molL-1、18.4 molL-1),设计实验方案来研究影响反应速率的因素。
(1)请帮助甲小组完成研究的实验报告:
实 验 步 骤 | 现 象 | 结 论 |
①分别取等体积0.5 molL-1硫酸于试管中 ②分别投入大小、形状相同的Mg、Fe、Cu ③观察金属表面产生气体的快慢 | ①产生气体的速率Mg>Fe ②Cu上无气体产生 | _________ |
根据控制变量法,要得出正确的实验结论,在实验过程中需要保持温度和压强相同。
(2)乙小组为了更精确地研究浓度对反应速率的影响,利用右图装置进行定量实验。该小组选用的实验药品是:Fe、2molL-1硫酸和______molL-1硫酸。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com