
【题目】血液属于胶体,透析是除去肾衰竭病人血液中的毒性物质、从而拯救病人生命的重要方法。透析的原理是
A.蒸发B.电泳C.过滤D.渗析
 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案科目:高中化学 来源: 题型:
【题目】以废旧锌锰电池初步处理分选出的含锰废料(MnO2、MnOOH、MnO及少量Fe、Pb等)为原料制备高纯MnCl2·xH2O,实现锰的再生利用。其工作流程如下:
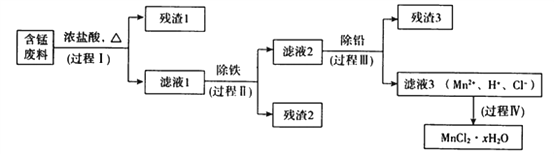
资料a.Mn的金属活动性强于Fe;Mn2+在酸性条件下比较稳定,pH高于5.5时易被O2氧化。
资料b.生成氢氧化物沉淀的pH
Mn(OH)2 | Pb(OH)2 | Fe(OH)3 | |
开始沉淀时 | 8.1 | 6.5 | 1.9 |
完全沉淀时 | 10.1 | 8.5 | 3.2 |
注:金属离子的起始浓度为0.1 mol·L-1
(1)过程Ⅰ的目的是浸出锰。经检验滤液1中含有的阳离子为Mn2+、Fe3+、Pb2+和H+。
①MnOOH与浓盐酸反应的离子方程式是_______________________________。
②检验滤液1中只含Fe3+不含Fe2+的操作和现象是:_________________________________________。
③Fe3+由Fe2+转化而成,可能发生的反应有:
a.2Fe2++Cl2=2Fe3+2Cl-
b.4Fe2++O2+4H+=2Fe3++2H2O
c.……
写出c的离子方程式:____________________。
(2)过程Ⅱ的目的是除铁。有如下两种方法,
ⅰ.氨水法:将滤液1先稀释,再加适量10%的氨水,过滤。
ⅱ.焙烧法:将滤液1浓缩得到的固体于290℃焙烧,冷却,取焙烧物,加水溶解,过滤,再加盐酸酸化至pH小于5.5。
已知:焙烧中发生的主要反应为2FeCl3+3O2=2Fe2O3+3Cl2,MnCl2和PbCl2不发生变化。
①氨水法除铁时,溶液pH应控制在_____________之间。
②两种方法比较,氨水法除铁的缺点是____________。
(3)过程Ⅲ的目的是除铅。加入的试剂是____________。
(4)过程Ⅳ所得固体中的x的测定如下,取m1g样品,置于氯化氢氛围中加热至失去全部结晶水时,质量变为m2g。则x=____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.06molFeCl2加入100mLK2Cr2O7溶液中,恰好使溶液中Fe2+全部转化为Fe3+ , Cr2O72﹣还原为Cr3+ . 则K2Cr2O7溶液的物质的量浓度为( )
A.0.05mol/L
B.0.1mol/L
C.0.2mol/L
D.0.3mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(14分)某工业原料主要成分是NH4Cl、FeCl3和AlCl3。利用此原料可以得到多种工业产品。分析下面流程,回答问题。
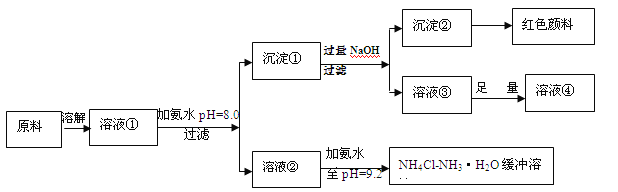
已知:Ksp[Fe(OH)3]=4.0×10-38
(1)用稀硫酸中和等体积等pH值的氨水和烧碱溶液,前者需要消耗的酸液体积 (填“大”“小”或“相同”)
(2)计算溶液②中Fe3+的物质的量浓度为 mol/L
(3)缓冲溶液中存在的平衡体系有: 、 、
此时溶液中c(NH4+) c(Cl-)(填>、=、<)。
(4)在缓冲溶液中加入少量盐酸或者NaOH溶液,溶液的pH值几乎依然为9.2。简述原理:
请举出另一种缓冲溶液的例子(写化学式) 。
(5)常温下向较浓的溶液④中不断通入HCl气体,可析出大量AlCl3·6H2O晶体,结合化学平衡移动原理解释析出晶体的原因: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列是用98%的浓H2SO4(ρ=1.84 g/cm3)配制500 mL 0.5 mol·L-1的稀硫酸的实验操作,请按要求填空:
(1) 计算所需浓硫酸的体积为________mL(保留一位小数);
(2) 如果实验室有10 mL、20 mL、50 mL的量筒,应选___________规格的量筒最好,如果量取浓硫酸时仰视读数,所配溶液浓度将(填“偏高”、“偏低”或“无影响”)___________;
(3) 将量取的浓硫酸沿烧杯内壁慢慢注入盛有约100 mL水的__里,并不断搅拌,搅拌的目的是_____;
(4) 将冷却至室温的上述溶液沿________注入________中,并用50 mL蒸馏水洗涤烧杯和玻璃棒2~3次,洗涤液要转入到容量瓶中,并振荡;
(5) 加水至距刻度线1~2 cm处,改用________加水至刻度线,使溶液的________________恰好跟容量瓶刻度线相平,把容量瓶塞好,反复颠倒振荡,摇匀溶液。
查看答案和解析>>
科目:高中化学 来源: 题型:
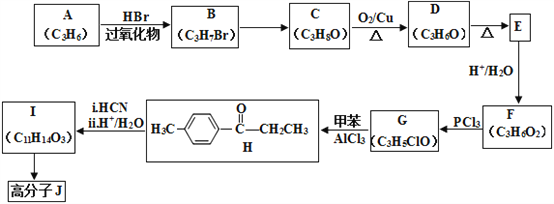
【题目】高分子合物J的合成路线如下:
已知:i. 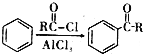
ii. 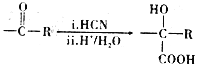
(1)写出A的结构简式:________________________。
(2)由B→C的反应条件为:________________,反应类型为:_________________。
(3)H中官能团名称:________________________。
(4)D 与新制的银氨溶液反应生成E的化学方程式:__________________________________________。
(5)由I合成高分子化合物J的化学方程式为____________________________________。
(6)有机物L(C9H10O3)符合下列条件的同分异构体有___________种。
①与FeCl3溶液发生显色反应
②与I具有相同的官能团
③苯环上有3个取代基,且只有一个烷基
(7)结合上述流程中的信息,设计由![]() 制备
制备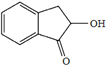 的合成路线。合成路线流程图示例:
的合成路线。合成路线流程图示例:
H2C=CH2![]() CH3CH2OH
CH3CH2OH![]() CH3COOC2H5,______________________。
CH3COOC2H5,______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机合成中间体的结构简式如图所示。下列关于该有机物的叙述不正确的是

A. 分子式为C9H9O4Br
B. 在一定条件下可与HCHO发生缩聚反应
C. 1 mol该物质与足量NaOH溶液混合加热,最多能消耗4mol NaOH
D. 1 mol该物质与浓溴水反应,最多能消耗3mol Br2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮氧化物是造成酸雨、臭氧空洞、光化学烟雾等环境问题的主要原因之一。如何消除大气污染物中氮氧化物已成为人们关注的主要问题之一。
I.NH3-SCR法是工业上消除氮氧化物的常用方法。该法是利用氨的还原性,在一定条件下,将烟气中的NOx直接还原为N2。
主要反应原理为:4NH3+4NO+O2![]() 4N2+6H2O
4N2+6H2O
(1)已知有下列热化学方程式:
①4NH3(g)+4NO(g)+O2(g)![]() 4N2(g)+6H2O(1) △H =-1891.5kJmol-1
4N2(g)+6H2O(1) △H =-1891.5kJmol-1
②N2(g)+O2(g)![]() 2NO(g) △H =+180.5kJmol-1
2NO(g) △H =+180.5kJmol-1
③H2O(1)=H2O(g) △H =+44.0kJmol-1
则氨气与氧气反应生成NO和气态水的热化学方程式为_________________________________。
(2)其他条件相同,某2 L密闭容器中分别投入2 mol NH3、2 mol NO、1 mol O2,在甲、乙两种催化剂作用下,NO转化率与温度的关系如图所示。
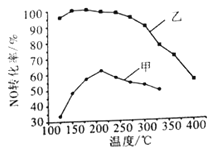
①工业上选择催化剂乙的原因是_________________。
②在催化剂甲作用下,高于210℃时,NO转化率降低的原因可能是_______________________。
Ⅱ.CH4可以消除氮氧化物的污染。主要反应原理为:CH4(g)+2NO2(g)= CO2(g)+2H2O(g)+ N2(g) △H=-868.7kJmol-1
(3)在3.00L密闭容器中,通入0.100mol CH4和0.200mol NO2,在一定温度下进行上述反应,反应时间(t)与容器内气体总压强(P) 的数据见下表:
反应时间t/min | 0 | 2 | 4 | 6 | 8 | 10 |
总压强P/100kPa | 4.80 | 5.44 | 5.76 | 5.92 | 6.00 | 6.00 |
由表中数据,计算0-4min内v(NO2)=____________,该温度下的平衡常数K=________________。
(4)在一恒容装置中,通入一定量CH4和NO2,测得在相同时间内和不同温度下,NO2的转化率α(NO2)如下图,则下列叙述正确的是_____________
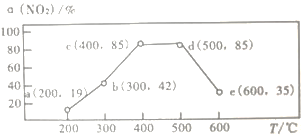
A.若温度维持在200℃更长时间,NO2的转化率将大于19%
B.反应速率:b点的v(逆)>e点的v(逆)
C.平衡常数: c点=d点
D.在时间t内,提高c点时NO2的转化率和反应速率,可适当升温或增大c(CH4)
Ⅲ.工业上也常采用电解的方法消除氮氧化物的污染。
(5)清华大学曹天宇等人研究的基于固体氧化物电解池(SOEC)
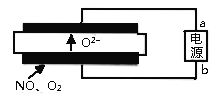
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com