
【题目】以废旧锌锰电池初步处理分选出的含锰废料(MnO2、MnOOH、MnO及少量Fe、Pb等)为原料制备高纯MnCl2·xH2O,实现锰的再生利用。其工作流程如下:
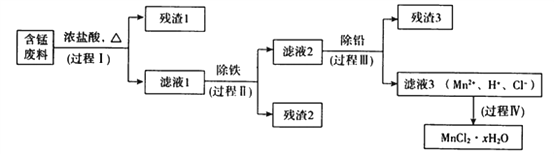
资料a.Mn的金属活动性强于Fe;Mn2+在酸性条件下比较稳定,pH高于5.5时易被O2氧化。
资料b.生成氢氧化物沉淀的pH
Mn(OH)2 | Pb(OH)2 | Fe(OH)3 | |
开始沉淀时 | 8.1 | 6.5 | 1.9 |
完全沉淀时 | 10.1 | 8.5 | 3.2 |
注:金属离子的起始浓度为0.1 mol·L-1
(1)过程Ⅰ的目的是浸出锰。经检验滤液1中含有的阳离子为Mn2+、Fe3+、Pb2+和H+。
①MnOOH与浓盐酸反应的离子方程式是_______________________________。
②检验滤液1中只含Fe3+不含Fe2+的操作和现象是:_________________________________________。
③Fe3+由Fe2+转化而成,可能发生的反应有:
a.2Fe2++Cl2=2Fe3+2Cl-
b.4Fe2++O2+4H+=2Fe3++2H2O
c.……
写出c的离子方程式:____________________。
(2)过程Ⅱ的目的是除铁。有如下两种方法,
ⅰ.氨水法:将滤液1先稀释,再加适量10%的氨水,过滤。
ⅱ.焙烧法:将滤液1浓缩得到的固体于290℃焙烧,冷却,取焙烧物,加水溶解,过滤,再加盐酸酸化至pH小于5.5。
已知:焙烧中发生的主要反应为2FeCl3+3O2=2Fe2O3+3Cl2,MnCl2和PbCl2不发生变化。
①氨水法除铁时,溶液pH应控制在_____________之间。
②两种方法比较,氨水法除铁的缺点是____________。
(3)过程Ⅲ的目的是除铅。加入的试剂是____________。
(4)过程Ⅳ所得固体中的x的测定如下,取m1g样品,置于氯化氢氛围中加热至失去全部结晶水时,质量变为m2g。则x=____________。
【答案】 2MnOOH+6H++2Cl-![]() 2Mn2++Cl2↑+4H2O 取少量滤液1于试管中,滴入铁氰化钾溶液,无蓝色沉淀生成或另取少量滤液1于试管中,滴加KSCN溶液,变红 MnO2+4H++2Fe2+=Mn2++2Fe3++2H2O或MnOOH+3H++Fe2+=Mn2++Fe3++2H2O 3.2~6.5 引入杂质NH4+ Mn 7(m1-m2)/m2
2Mn2++Cl2↑+4H2O 取少量滤液1于试管中,滴入铁氰化钾溶液,无蓝色沉淀生成或另取少量滤液1于试管中,滴加KSCN溶液,变红 MnO2+4H++2Fe2+=Mn2++2Fe3++2H2O或MnOOH+3H++Fe2+=Mn2++Fe3++2H2O 3.2~6.5 引入杂质NH4+ Mn 7(m1-m2)/m2
【解析】(1)①含锰废料(MnO2、MnOOH、MnO及少量Fe、Pb等)与浓盐酸反应,过滤滤液1中含有的阳离子为Mn2+、Fe3+、Pb2+和H+,所以浓盐酸与MnOOH反应,Mn元素化合价降低到+2价,-1价的Cl-被氧化产生氯气,离子方程式:2MnOOH+6H++2Cl-![]() 2Mn2++Cl2↑+4H2O;②要检验滤液1中只含Fe3+不含Fe2+,取滤液1分在2支试管中,一支试管中滴加铁氰化钾溶液,无明显变化,说明滤液1中无Fe2+,另一支试管中滴加KSCN溶液,溶液变红说明滤液1中有Fe3+;③Fe3+由Fe2+转化而成,可能是由氯气、氧气氧化Fe2+,也可能由MnO2、MnOOH氧化Fe2+,所以可能发生的反应为:MnO2+4H++2Fe2+=Mn2++2Fe3++2H2O或MnOOH+3H++Fe2+=Mn2++Fe3++2H2O正确答案为:MnO2+4H++2Fe2+=Mn2++2Fe3++2H2O或MnOOH+3H++Fe2+=Mn2++Fe3++2H2O;
2Mn2++Cl2↑+4H2O;②要检验滤液1中只含Fe3+不含Fe2+,取滤液1分在2支试管中,一支试管中滴加铁氰化钾溶液,无明显变化,说明滤液1中无Fe2+,另一支试管中滴加KSCN溶液,溶液变红说明滤液1中有Fe3+;③Fe3+由Fe2+转化而成,可能是由氯气、氧气氧化Fe2+,也可能由MnO2、MnOOH氧化Fe2+,所以可能发生的反应为:MnO2+4H++2Fe2+=Mn2++2Fe3++2H2O或MnOOH+3H++Fe2+=Mn2++Fe3++2H2O正确答案为:MnO2+4H++2Fe2+=Mn2++2Fe3++2H2O或MnOOH+3H++Fe2+=Mn2++Fe3++2H2O;
(2)①根据题干信息:Fe(OH)3开始沉淀的PH=1.9,完全沉淀的PH=3.2,Mn(OH)2开始沉淀的PH=8.1,Pb(OH)2开始沉淀的PH=6.5,调节pH除去铁离子,pH大于3.2时,铁离子沉淀完全,铅离子、锰离子不能沉淀,所以pH应小于6.5,正确答案为:3.2~6.5;②氨水法除铁的过程中存在NH4+离子,所以两种方法比较,此方法的缺点是引入杂质NH4+,正确答案是:引入杂质NH4+离子;
(3)根据题干信息:Mn的金属活动性强于Fe和金属活动顺序表可知:Mn的金属性比Pb强,因此加入锰,将铅离子置换与溶液分离,自身生成锰离子,不引入杂质,正确答案是:加入的试剂是Mn;
(4)m1gMnCl2xH2O置于氯化氢氛围中加热至失去全部结晶水时,生成MnCl2质量为m2g,则结晶水的质量为m(H2O)=(m1-m2)g,根据方程式MnCl2·xH2O![]() MnCl2+xH2O计算:126:18x=m2:(m1-m2),x=7(m1-m2)/m2,正确答案:x=7(m1-m2)/m2。
MnCl2+xH2O计算:126:18x=m2:(m1-m2),x=7(m1-m2)/m2,正确答案:x=7(m1-m2)/m2。


 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源: 题型:
【题目】如图所示装置进行实验,将液体A逐滴加入到固体B中,下列叙述中不正确的是( )

A. 若A为醋酸,B为贝壳(粉状),C为澄清石灰水溶液,则C中溶液变浑浊
B. 若A为浓盐酸,B为锌粒,C中盛滴有酚酞的NaOH溶液,则C中溶液褪色
C. 若A为双氧水,B为MnO2,C中为NaOH溶液,D为防倒吸装置
D. 实验中仪器D可起到防倒吸的作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在标准状况下,4.48LCH4和CO2的混合气体质量为6.0g,则该混合气体的平均摩尔质量为____,其中CH4和CO2的物质的量之比为____。
(2)将17.1gBa(OH)2溶解在水中,配成100mL溶液,配好后从中取出10mL溶液,加水稀释至100mL,则稀释后所得溶液中OH-的物质的量浓度是__________mol/L。
(3)在标准状况下,VL某气体(摩尔质量为Mg/mol)溶解在1L水(水的密度近似为1g/cm3)中,假设气体完全溶解且不与水发生反应,所得溶液的密度为ρg/cm3,则所得溶液的物质的量浓度c=______mol/L(用以上字母表示,且必须化简)。
(4)ZnSO4溶液中含有少量Fe2+,为了除去这种离子,调节溶液的pH为5,然后加入高锰酸钾溶液,使之生成沉淀。已知高锰酸钾的还原产物是MnO2,则该反应的离子方程式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的分离方法不正确的是( )
A.用过滤的方法除去食盐水中的泥沙
B.用蒸馏的方法将自来水制成蒸馏水
C.用酒精萃取碘水中的碘
D.用淘洗的方法从沙里淘金
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1.5 mol Cu2S和足量稀HNO3反应,生成Cu(NO3)2、H2SO4、NO和H2O。则参加反应的硝酸中被还原的硝酸的物质的量是
A. 5 mol B. 1.5 mol C. 6 mol D. 1mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合物A,含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下可实现下图所示的物质之间的变化:
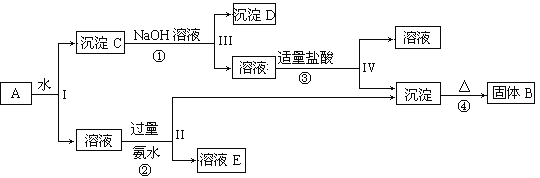
据此回答下列问题:
(1)I、II、III、IV四步中分离溶液和沉淀所采取的操作名称是____________。
(2)①、③反应的离子方程式:
①_____________________________________________________________;
③_____________________________________________________________。
(3)有人认为③用盐酸不是太好,改为通入足量的一种气体,这种气体为______。该离子反应方程式为:________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com