
【题目】下列物质的分离方法不正确的是( )
A.用过滤的方法除去食盐水中的泥沙
B.用蒸馏的方法将自来水制成蒸馏水
C.用酒精萃取碘水中的碘
D.用淘洗的方法从沙里淘金
科目:高中化学 来源: 题型:
【题目】研究物质制备是化学学科的任务之一。
(1)请从Cl2、H2、CO2、NO、NH3五种气体中选择一种气体,该气体在实验室可用如图装置制取、净化、收集(可以含水蒸气),制取该气体的化学方程式为____________。

(2)已知: +4NaOH→NaCl+CH2=CH2↑+Na3PO4+3H2O,可用下述装置制取1,2-二溴乙烷(无色液体,密度2.18g·cm-3,熔、沸点分别为9.79℃、131.4 ℃,不溶于水);试管d中装有液溴(表面覆盖少量水)。
+4NaOH→NaCl+CH2=CH2↑+Na3PO4+3H2O,可用下述装置制取1,2-二溴乙烷(无色液体,密度2.18g·cm-3,熔、沸点分别为9.79℃、131.4 ℃,不溶于水);试管d中装有液溴(表面覆盖少量水)。

①e装置的作用是_________;当观察到_________现象时,试管d中反应基本结束;
②若用冰水代替烧杯中的冷水,可能引起的不安全后果是_________;
③实验后,需通过水洗、________、水洗、用干燥剂干燥、蒸馏等操作对试管d中的粗产品进行精制:
④实验消耗40%乙烯利(摩尔质量为M)溶液50g,制得产品m g,则乙烯利合成1,2-二溴乙烷的产率为____________(用含M、m的代数式表示);
⑤设计实验证明,反应后烧瓶中的混合溶液含有C1-、PO43-。简述实验方案:_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜及其化合物的用途非常广泛,回答下列问题:
(1)基态铜原子有种不同运动状态的电子,二价铜离子的电子排布式为________。
(2)铜能与类卤素(CN)2反应生成Cu(CN)2 1mol(CN)2分子中含有π键的数目为___________。
(3)CuCl2溶液与乙二胺(H2N-CH2-CH2-NH2)可形成配离子[Cu(En)2]2+(En是乙二胺的简写),结构如图所示,
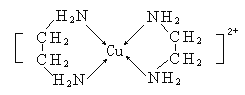
则Cu2+的配位数为_________,该配离子中所含的非金属元素的电负性由大到小的顺序是________;乙二胺分子中氮原子轨道的杂化类型为______,乙二胺和三甲胺[N(CH3)3]均属于胺,但相对分子质量相近,但乙二胺比三甲胺的沸点高的多,原因是__________。
(4)铜晶体中铜原子的堆积方式为面心立方堆积,每个铜原子周围距离最近的铜原子数目为________。
(5)某M原子的外围电子排布是为3s23p5,铜与M形成化合物的晶胞如图所示(黑球代表铜原子)。
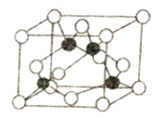
①已知铜和M的电负性分别为1.9和3.0,则铜与M形成的该种化合物属于________ (填“离子”或“共价”)化合物。
②已知该晶体的密度为ρg·cm-3,阿伏加德罗常数为NA,则该晶体中铜原子和M原子之间的最短距离为______pm(只写计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳和硅是自然界中大量存在的元素,硅及其化合物是工业上最重要的材料。粗硅的制备有二种方法:
方法一:SiO2+2C![]() Si+2CO↑ 方法二:SiO2+2Mg
Si+2CO↑ 方法二:SiO2+2Mg![]() Si+2MgO (可能用到的相对原子质量:B-11 P-31)
Si+2MgO (可能用到的相对原子质量:B-11 P-31)
(1)基态硅原子中存在____________对自旋相反的电子,基态Mg的最外层电子所占据的能级的电子云能廓图是________。
(2)上述反应中所有元素第一电离能最小的元素是________(填元素符号)。
(3)试比较C(金刚石),晶体Si,CO三种物质的熔沸点从高到低的顺序___________________,试解释原因:____________________。
(4)CO在配合物中可作为配体,在Cr(CO)6配合物中配原子是________(填元素符号)1mol该配合物中含有π键的数目_________。
(5)SiO2晶跑(如下图)可理解成将金刚石晶胞(如下图)中的C原子置换成Si原子,然后在Si-Si之间插入O原子而形成。


①推测SiO2晶胞中Si采用________杂化,O-Si-O的键角________________。
②SiO2晶跑中,含有Si原子____________个和O原子______________个。
③假设金刚石晶胞的边长为apm,试计算该晶胞的密度_________g/cm3(写出表达式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以废旧锌锰电池初步处理分选出的含锰废料(MnO2、MnOOH、MnO及少量Fe、Pb等)为原料制备高纯MnCl2·xH2O,实现锰的再生利用。其工作流程如下:
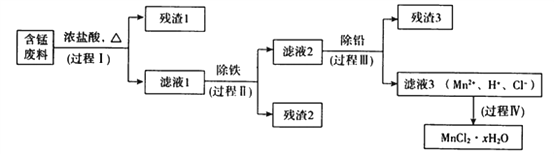
资料a.Mn的金属活动性强于Fe;Mn2+在酸性条件下比较稳定,pH高于5.5时易被O2氧化。
资料b.生成氢氧化物沉淀的pH
Mn(OH)2 | Pb(OH)2 | Fe(OH)3 | |
开始沉淀时 | 8.1 | 6.5 | 1.9 |
完全沉淀时 | 10.1 | 8.5 | 3.2 |
注:金属离子的起始浓度为0.1 mol·L-1
(1)过程Ⅰ的目的是浸出锰。经检验滤液1中含有的阳离子为Mn2+、Fe3+、Pb2+和H+。
①MnOOH与浓盐酸反应的离子方程式是_______________________________。
②检验滤液1中只含Fe3+不含Fe2+的操作和现象是:_________________________________________。
③Fe3+由Fe2+转化而成,可能发生的反应有:
a.2Fe2++Cl2=2Fe3+2Cl-
b.4Fe2++O2+4H+=2Fe3++2H2O
c.……
写出c的离子方程式:____________________。
(2)过程Ⅱ的目的是除铁。有如下两种方法,
ⅰ.氨水法:将滤液1先稀释,再加适量10%的氨水,过滤。
ⅱ.焙烧法:将滤液1浓缩得到的固体于290℃焙烧,冷却,取焙烧物,加水溶解,过滤,再加盐酸酸化至pH小于5.5。
已知:焙烧中发生的主要反应为2FeCl3+3O2=2Fe2O3+3Cl2,MnCl2和PbCl2不发生变化。
①氨水法除铁时,溶液pH应控制在_____________之间。
②两种方法比较,氨水法除铁的缺点是____________。
(3)过程Ⅲ的目的是除铅。加入的试剂是____________。
(4)过程Ⅳ所得固体中的x的测定如下,取m1g样品,置于氯化氢氛围中加热至失去全部结晶水时,质量变为m2g。则x=____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种可连续使用的锂电池结构如图所示,下列有关该电池放电时的说法正确的是

A. 电子由Li电极经Li+透过膜进入Fe2+、Fe3+的水溶液移向Ti电极
B. Ti电极上发生的电极反应为:Fe3+ + e- = Fe2+
C. Li+透过膜除允许Li+通过外,还允许H2O分子通过
D. 贮罐中发生的离子反应为:S2O82- + 2Fe3+ = 2Fe2+ + 2SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,水的电离达到平衡:H2O![]() H+ + OH-,下列叙述正确的是
H+ + OH-,下列叙述正确的是
A. 向水中加入稀氨水,平衡逆向移动,c(OH-)降低
B. 向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变
C. 向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低
D. 将水加热,Kw增大,pH不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列说法中正确的数目是
①12.0g熔融的NaHSO4中含有的阳离子数为0.2NA
②1mol Na2O 和Na2O2混合物中含有的阴、阴离子总数是3NA
③常温常压下,92g的NO2和N2O4混合气体含有的原子数为6NA
④7.8g![]() 中含有的碳碳双键数目为0.3NA
中含有的碳碳双键数目为0.3NA
⑤用1L1.0 mol/LFeCl3溶液制备氢氧化铁胶体,所得氢氧化铁胶粒的数目为NA
⑥1mol SO2与足量O2在一定条件下充分反应生成SO3,共转移2NA个电子
⑦在反应KIO3+6HI=KI+3I2 +3H2O 中,每生成3molI2转移的电子数为5NA
⑧常温常压下,17 g甲基(-14CH3)中所含的中子数为9NA
A. 3 B. 4 C. 5 D. 6
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com