
����Ŀ����NA��ʾ�����ӵ�������ֵ������˵������ȷ����Ŀ��
��12.0g���ڵ�NaHSO4�к��е���������Ϊ0.2NA
��1mol Na2O ��Na2O2�����������������������3NA
�۳��³�ѹ�£�92g��NO2��N2O4������庬�е�ԭ����Ϊ6NA
��7.8g![]() �к��е�̼̼˫����ĿΪ0.3NA
�к��е�̼̼˫����ĿΪ0.3NA
����1L1.0 mol/LFeCl3��Һ�Ʊ������������壬��������������������ĿΪNA
��1mol SO2������O2��һ�������³�ַ�Ӧ����SO3����ת��2NA������
���ڷ�ӦKIO3+6HI=KI+3I2 +3H2O �У�ÿ����3molI2ת�Ƶĵ�����Ϊ5NA
�ೣ�³�ѹ�£�17 g��(��14CH3)��������������Ϊ9NA
A. 3 B. 4 C. 5 D. 6
���𰸡�A
����������n��NaHSO4��=![]() =0.1mol��NaHSO4������״̬�µĵ��뷽��ʽΪNaHSO4=Na++HSO4-��12.0g���ڵ�NaHSO4�к��е����������ʵ���Ϊ0.1mol������������Na2O��Na2O2�����������Ӹ���֮�ȶ�Ϊ1:2��1molNa2O��Na2O2������к��е����������������ʵ���Ϊ3mol������ȷ����NO2��N2O4��ʵ��ʽ����NO2��n��NO2��=
=0.1mol��NaHSO4������״̬�µĵ��뷽��ʽΪNaHSO4=Na++HSO4-��12.0g���ڵ�NaHSO4�к��е����������ʵ���Ϊ0.1mol������������Na2O��Na2O2�����������Ӹ���֮�ȶ�Ϊ1:2��1molNa2O��Na2O2������к��е����������������ʵ���Ϊ3mol������ȷ����NO2��N2O4��ʵ��ʽ����NO2��n��NO2��=![]() =2mol�����³�ѹ��92g��NO2��N2O4�������������ԭ�����ʵ���Ϊ6mol������ȷ�������в���̼̼˫��������������n��FeCl3��=1.0mol/L
=2mol�����³�ѹ��92g��NO2��N2O4�������������ԭ�����ʵ���Ϊ6mol������ȷ�������в���̼̼˫��������������n��FeCl3��=1.0mol/L![]() 1L=1mol�����ݷ�ӦFeCl3+3H2O
1L=1mol�����ݷ�ӦFeCl3+3H2O![]() Fe��OH��3�����壩+3HCl������1molFe��OH��3����������������һ����ĿFe��OH��3�ļ����壬�����������������ʵ���С��1mol��������������1molSO2ȫ����Ӧ��ת��2mol��������SO2��O2�ķ�Ӧ�ǿ��淴Ӧ��1molSO2������O2��һ�������³�ַ�Ӧ����SO3��ת�Ƶ������ʵ���С��2mol��������������˫���ŷ����÷�Ӧ��
Fe��OH��3�����壩+3HCl������1molFe��OH��3����������������һ����ĿFe��OH��3�ļ����壬�����������������ʵ���С��1mol��������������1molSO2ȫ����Ӧ��ת��2mol��������SO2��O2�ķ�Ӧ�ǿ��淴Ӧ��1molSO2������O2��һ�������³�ַ�Ӧ����SO3��ת�Ƶ������ʵ���С��2mol��������������˫���ŷ����÷�Ӧ��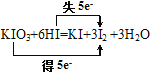 ��ÿ����3molI2ת��5mol����������ȷ����n��-14CH3��=
��ÿ����3molI2ת��5mol����������ȷ����n��-14CH3��=![]() =1mol�������������ʵ���Ϊ8mol������������ȷ�����ڢۢ�����ѡA��
=1mol�������������ʵ���Ϊ8mol������������ȷ�����ڢۢ�����ѡA��


 Сѧѧϰ�ð���ϵ�д�
Сѧѧϰ�ð���ϵ�д� Сѧͬ�����������ܾ�ϵ�д�
Сѧͬ�����������ܾ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ԫ���ܹ��γɶ��ֻ������ش��������⣺
��1������(N2H4)������ΪҺ̬���ڿ�����Ѹ����ȫȼ������N2��ͬʱ�������ȣ���������������ɴ��������ȼ�ϡ�
��֪��H2(g)+1/2O2(g) = H2O(l) ��H1= ��285.8kJ/mol
N2(g)+2H2(g) = N2H4(l) ��H2= + 50.6kJ/mol
��N2H4(l)�ڿ���ȼ������Һ̬ˮ���Ȼ�ѧ����ʽΪ_______________________��
��2�����ð�������������(HCN)�ķ�ӦCH4(g)+NH3(g)=HCN(g)+3H2(g)��H>0
��һ���¶��£���2L���������г���1molCH4(g)��2molNH3(g)����������Ӧ��4min�ﵽƽ��ʱ�����CH4ƽ��ת����Ϊ66.67%��0~4min�ڣ���H2��ʾ�ĸ÷�Ӧ����v(H2)=___________�������¶Ⱥ��ݻ����䣬����ƽ���������г���2molNH3��2molH2����ʱv�� ___v��(ѡ����>����<������=��)��
��ƽ����ϵ��HCN�����ʵ���(n)��ij�������仯������ͼ��ʾ(ͼ��x��L�ֱ��ʾ�¶Ȼ�ѹǿ)��
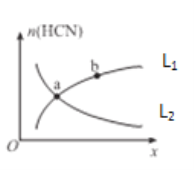
��xΪ�¶ȣ������ߣ�____(ѡ����L1������L2��)����ȷ��ʾn(HCN)���¶ȵĹ�ϵ��
��xΪѹǿ��������____(ѡ����L1������L2��)����ȷ��ʾn(HCN)��ѹǿ�Ĺ�ϵ��
��3��NH3�ܹ��γ�Ag(NH3)2+��
��֪��Һ�д���Ag+(aq)+2NH3(aq)==Ag(NH3)2+(aq)�������¸÷�Ӧƽ�ⳣ��K1=1.10��107����ӦAgCl(s)+2NH3(aq) ![]() Ag(NH3)2+(aq) +Cl-(aq)�Ļ�ѧƽ�ⳣ��K2=1.936��10-3����Ksp(AgCl)=____________��
Ag(NH3)2+(aq) +Cl-(aq)�Ļ�ѧƽ�ⳣ��K2=1.936��10-3����Ksp(AgCl)=____________��
��4����������͵��������dz����Ĵ�����Ⱦ�������ͼ��ʾװ��(�缫��Ϊ���Ե缫)������SO2�����������ų�����Һ����NO2��
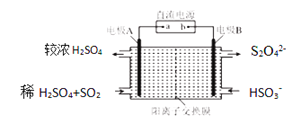
���缫A�ĵ缫��ӦʽΪ__________________________________��
���ڼ��������£��������ų�����Һ����NO2��ʹ��ת��Ϊ�����壬ͬʱ��SO32-���ɡ��÷�Ӧ���ӷ���ʽΪ________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʵķ��뷽������ȷ���ǣ�������
A.�ù��˵ķ�����ȥʳ��ˮ�е���ɳ
B.������ķ���������ˮ�Ƴ�����ˮ
C.�þƾ���ȡ��ˮ�еĵ�
D.����ϴ�ķ�����ɳ���Խ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ���ǣ�������
A.�����ЧӦ�����ڼ��������Һ
B.�������ӵ�ֱ����1��100 nm֮��
C.����һ���ǻ����
D.��FeCl3ϡ��Һ������ˮ�����Ƶ�Fe��OH��3����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�����A������KAl(SO4)2��Al2O3��Fe2O3����һ�������¿�ʵ����ͼ��ʾ������֮��ı仯��
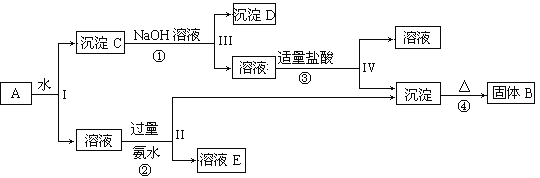
�ݴ˻ش��������⣺
��1��I��II��III��IV�IJ��з�����Һ�ͳ�������ȡ�IJ���������____________��
��2���١��۷�Ӧ�����ӷ���ʽ��
��_____________________________________________________________��
��_____________________________________________________________��
��3��������Ϊ���������̫�ã���Ϊͨ��������һ�����壬��������Ϊ______�������ӷ�Ӧ����ʽΪ��________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ������������Լ�ԭ����ȫ��Ӧ����
ʵ����� | ʵ������ | ԭ�� | |
A | �����£���Ũ�Ⱦ�Ϊ0.01mol��L-1��BaCl2��CaCl2�����Һ�еμ�Na2SO4��Һ | ���ְ�ɫ���� | Ksp(BaSO4)< Ksp(CaSO4) |
B | ��ˮ����ͨ�����ȵ����� | ���۱�Ϊ��ɫ | ��������ˮ�ڸ����·�����Ӧ |
C | �����ˮ��IJ����м������Ƶ�������Һ | û�г����������� | ���������Ƶ�������Һ�����˷�Ӧ |
D | ��ͬ�¶��£�����ͬ��С�ƿ�ֱ�ӵ�ˮ�����ᡢ�Ҵ��� | �������������ʣ�����>ˮ>�Ҵ� | ���ֵ���ʵ���H+����������>ˮ>�Ҵ� |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Һ���������Һ�����ַ�ɢϵ�ĸ��������ǣ�������
A.���
B.��ɢ�����ӵĴ�С
C.�Ƿ���ͨ����ֽ
D.�Ƿ��ж����ЧӦ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ܱ������е�һ����������巢����Ӧ��x A(g) + yB(g) ![]() z C(g)��ƽ��ʱ���A��Ũ��Ϊ0.50mol/L�������¶Ȳ��䣬���������ݻ�����ԭ����2�����ٴ�ƽ��ʱ�����A��Ũ��Ϊ0.30mol/L�������й��ж���ȷ������ ��
z C(g)��ƽ��ʱ���A��Ũ��Ϊ0.50mol/L�������¶Ȳ��䣬���������ݻ�����ԭ����2�����ٴ�ƽ��ʱ�����A��Ũ��Ϊ0.30mol/L�������й��ж���ȷ������ ��
A. x+y>z B. ƽ��������Ӧ�����ƶ� C. B��ת�������� D. C�������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й����Ҵ���˵���У�����ȷ���ǣ� ��
A.������Ϊ��OHB.����NaOH��Ӧ
C.��ʹ���Եĸ��������Һ��ɫD.������ɱ������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com