
【题目】铜及其化合物的用途非常广泛,回答下列问题:
(1)基态铜原子有种不同运动状态的电子,二价铜离子的电子排布式为________。
(2)铜能与类卤素(CN)2反应生成Cu(CN)2 1mol(CN)2分子中含有π键的数目为___________。
(3)CuCl2溶液与乙二胺(H2N-CH2-CH2-NH2)可形成配离子[Cu(En)2]2+(En是乙二胺的简写),结构如图所示,
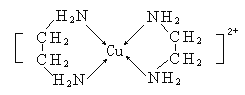
则Cu2+的配位数为_________,该配离子中所含的非金属元素的电负性由大到小的顺序是________;乙二胺分子中氮原子轨道的杂化类型为______,乙二胺和三甲胺[N(CH3)3]均属于胺,但相对分子质量相近,但乙二胺比三甲胺的沸点高的多,原因是__________。
(4)铜晶体中铜原子的堆积方式为面心立方堆积,每个铜原子周围距离最近的铜原子数目为________。
(5)某M原子的外围电子排布是为3s23p5,铜与M形成化合物的晶胞如图所示(黑球代表铜原子)。
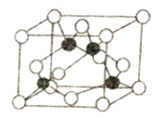
①已知铜和M的电负性分别为1.9和3.0,则铜与M形成的该种化合物属于________ (填“离子”或“共价”)化合物。
②已知该晶体的密度为ρg·cm-3,阿伏加德罗常数为NA,则该晶体中铜原子和M原子之间的最短距离为______pm(只写计算式)。
【答案】 1s22s22p63s23p63d9[Ar]3d9 4NA 4 N>C>H sp3 乙二胺分子之间可以形成氢键,三甲胺分子间不能形成氢键 12 共价 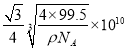
【解析】(1)Cu为29号元素,二价铜离子的电子排布式为:1s22s22p63s23p63d9(或[Ar]3d9);答案为:1s22s22p63s23p63d9或[Ar]3d9
(2) (CN)2分子的结构式为N≡C-C≡N,1个N≡C键中有1个σ键,2个π键,1mol(CN)2分子中含有π键的数目为4NA;答案为:4NA
(3)由结构图可知配离子[Cu(En)2]2+中Cu2+的配位数为4;同周期元素自左向右,电负性逐渐增大,故电负性:N>C,H元素分别与C、N元素化合时,H元素表现正化合价,H元素的电负性比C、N元素的小,故电负性:N>C>H;乙二胺(H2N-CH2-CH2-NH2)中N原子形成3个σ键,含有1对孤对电子对,杂化轨道数为4,采取sp3杂化;乙二胺(H2N-CH2-CH2-NH2)分子之间可以形成氢键,三甲胺[N(CH3)3]分子之间不能形成氢键,故乙二胺的沸点较高;答案为:4 ,N>C>H , sp3 ,乙二胺分子之间可以形成氢键,三甲胺分子间不能形成氢键。
(4)根据面心立方堆积形成的晶胞可知,每个铜原子周围距离最近的铜原子位于经过立方体的面的面心上,共有12个;答案为:12
(5)根据M原子的外围电子排布式为3s23p5可知,M为Cl元素,根据晶胞结构可知,铜原子位于立方体内部,全部属于晶胞,氯原子位于立方体的顶点和面心,所以铜原子个数为4,氯原子个数=8×![]() +6×
+6×![]() =4,所以二者形成的化合物的化学式为CuCl;
=4,所以二者形成的化合物的化学式为CuCl;
①铜和M的电负性相差3.01.9=1.1,电负性差大于1.7的键一般是离子键,小于1.7的一般为共价键,故Cu与M形成的化合物属于共价化合物;
②CuCl的相对分子质量99.5,一个晶胞中含有4个CuCl,所以一个晶胞的摩尔质量为4×99.5g/mol,晶胞的摩尔体积为![]() =
=![]() cm3/mol,晶胞的边长为
cm3/mol,晶胞的边长为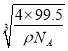 cm,根据晶胞的结构可知,铜原子和M原子之间的最短距离为立方体对角线长的
cm,根据晶胞的结构可知,铜原子和M原子之间的最短距离为立方体对角线长的![]() ,而体对角线为晶胞边长的
,而体对角线为晶胞边长的![]() 倍,所以铜原子和M原子之间的最短距离为:
倍,所以铜原子和M原子之间的最短距离为: 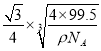 cm=
cm=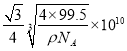 pm。答案为:共价 ,
pm。答案为:共价 , 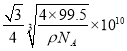


科目:高中化学 来源: 题型:
【题目】300 ℃时,将2 mol A和2 mol B两种气体混合于2 L密闭容器中,发生如下反应:3A(g)+B(g)![]() 2 C(g)+2D(g) ΔH=Q, 2 min末达到平衡,生成0.8 mol D。
2 C(g)+2D(g) ΔH=Q, 2 min末达到平衡,生成0.8 mol D。
(1)300℃时,该反应的平衡常数表达式为K=______________,已知K300℃<K350℃,则ΔH____0(填“>”或“<”)。
(2)在2 min末时,B的平衡浓度为________,D的平均反应速率为________。
(3)若温度不变,缩小容器容积,则A的转化率________(填“增大”“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮元素能够形成多种化合物。请回答下列问题:
(1)联氨(N2H4)常温下为液态,在空气中迅速完全燃烧生成N2,同时大量放热,可作导弹、宇宙飞船、火箭的燃料。
已知:H2(g)+1/2O2(g) = H2O(l) △H1= —285.8kJ/mol
N2(g)+2H2(g) = N2H4(l) △H2= + 50.6kJ/mol
则N2H4(l)在空气燃烧生成液态水的热化学方程式为_______________________。
(2)利用氨气生产氢氰酸(HCN)的反应CH4(g)+NH3(g)=HCN(g)+3H2(g)△H>0
①一定温度下,向2L恒容容器中充入1molCH4(g)和2molNH3(g)发生上述反应,4min达到平衡时,测得CH4平衡转化率为66.67%,0~4min内,用H2表示的该反应速率v(H2)=___________。保持温度和容积不变,再向平衡后的容器中充入2molNH3和2molH2,此时v正 ___v逆(选填“>”“<”或“=”)。
②平衡体系中HCN的物质的量(n)随某物理量变化曲线如图所示(图中x、L分别表示温度或压强)。
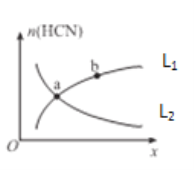
若x为温度,则曲线,____(选填“L1”或“L2”)能正确表示n(HCN)与温度的关系;
若x为压强,则曲线____(选填“L1”或“L2”)能正确表示n(HCN)与压强的关系。
(3)NH3能够形成Ag(NH3)2+。
已知溶液中存在Ag+(aq)+2NH3(aq)==Ag(NH3)2+(aq),常温下该反应平衡常数K1=1.10×107,反应AgCl(s)+2NH3(aq) ![]() Ag(NH3)2+(aq) +Cl-(aq)的化学平衡常数K2=1.936×10-3,则Ksp(AgCl)=____________。
Ag(NH3)2+(aq) +Cl-(aq)的化学平衡常数K2=1.936×10-3,则Ksp(AgCl)=____________。
(4)硫氧化物和氮氧化物是常见的大气污染物,利用如图所示装置(电极均为惰性电极)可吸收SO2,并用阴极排出的溶液吸收NO2。
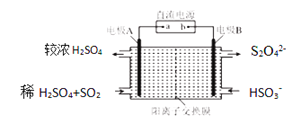
①电极A的电极反应式为__________________________________。
②在碱性条件下,用阴极排出的溶液吸收NO2,使其转化为无害气体,同时有SO32-生成。该反应离子方程式为________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在标准状况下,4.48LCH4和CO2的混合气体质量为6.0g,则该混合气体的平均摩尔质量为____,其中CH4和CO2的物质的量之比为____。
(2)将17.1gBa(OH)2溶解在水中,配成100mL溶液,配好后从中取出10mL溶液,加水稀释至100mL,则稀释后所得溶液中OH-的物质的量浓度是__________mol/L。
(3)在标准状况下,VL某气体(摩尔质量为Mg/mol)溶解在1L水(水的密度近似为1g/cm3)中,假设气体完全溶解且不与水发生反应,所得溶液的密度为ρg/cm3,则所得溶液的物质的量浓度c=______mol/L(用以上字母表示,且必须化简)。
(4)ZnSO4溶液中含有少量Fe2+,为了除去这种离子,调节溶液的pH为5,然后加入高锰酸钾溶液,使之生成沉淀。已知高锰酸钾的还原产物是MnO2,则该反应的离子方程式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在三个等体积的恒容密闭容器中,反应2CO2(g)+6H2(g) ![]() C2H5OH(g)+3H2O(g)达平衡,下列说法正确的是
C2H5OH(g)+3H2O(g)达平衡,下列说法正确的是
容器 | 温度/K | 物质的起始浓度(mol/L) | 物质的平衡浓度(mol/L) | |||
CO2(g) | H2(g) | C2H5OH(g) | H2O(g) | C2H5OH(g) | ||
甲 | 500 | 0.20 | 0.60 | 0 | 0 | 0.083 |
乙 | 500 | 0.40 | 1.20 | 0 | 0 | |
丙 | 600 | 0 | 0 | 0.10 | 0.30 | 0.039 |
A. 该反应正反应为吸热反应
B. 达平衡时,容器甲中的逆反应速率比容器乙中的小
C. 达平衡时,转化率:α(CO2 ,甲)+α(C2H5OH ,丙)>1
D. 达平衡时,甲、乙容器内:2c(CO2 ,甲)<c(CO2 ,乙)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的分离方法不正确的是( )
A.用过滤的方法除去食盐水中的泥沙
B.用蒸馏的方法将自来水制成蒸馏水
C.用酒精萃取碘水中的碘
D.用淘洗的方法从沙里淘金
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com