
【题目】一定温度下,在三个等体积的恒容密闭容器中,反应2CO2(g)+6H2(g) ![]() C2H5OH(g)+3H2O(g)达平衡,下列说法正确的是
C2H5OH(g)+3H2O(g)达平衡,下列说法正确的是
容器 | 温度/K | 物质的起始浓度(mol/L) | 物质的平衡浓度(mol/L) | |||
CO2(g) | H2(g) | C2H5OH(g) | H2O(g) | C2H5OH(g) | ||
甲 | 500 | 0.20 | 0.60 | 0 | 0 | 0.083 |
乙 | 500 | 0.40 | 1.20 | 0 | 0 | |
丙 | 600 | 0 | 0 | 0.10 | 0.30 | 0.039 |
A. 该反应正反应为吸热反应
B. 达平衡时,容器甲中的逆反应速率比容器乙中的小
C. 达平衡时,转化率:α(CO2 ,甲)+α(C2H5OH ,丙)>1
D. 达平衡时,甲、乙容器内:2c(CO2 ,甲)<c(CO2 ,乙)
【答案】BC
【解析】A、丙和甲比较,将丙中的生成物按照“一边倒”的方法转化为反应物,温度相同时,甲和丙构成等效平衡,平衡时乙醇的浓度应相等,现在丙在甲的基础上升温,乙醇的浓度降低,平衡逆向移动,可知逆反应为吸热反应,则正反应为放热反应,A错误;B、甲中反应物的浓度小于乙中反应物的浓度,所以甲乙达到平衡时,甲中的速率小于乙中的速率,故容器甲中的逆反应速率比容器乙中的小,B正确;C、α(CO2,甲)=0.083×2÷0.2×100% =83%,α(C2H5OH,丙)=( 0.10-0.039)÷0.1×100%=61%,α(CO2,甲)+α(C2H5OH,丙)=144%>1,C正确;D、乙中起始投料是甲中的2倍,如果容器体积可以变化,则甲乙是等效平衡,乙中CO2的浓度与甲中CO2的浓度相等,现在两个容器的体积相等,故可将乙容器的体积缩小一半,假设平衡不移动,则乙中CO2的浓度扩大一倍,即乙中CO2的浓度是甲中CO2浓度的2倍,但缩小体积,平衡将正向移动,所以乙中CO2的浓度小于甲中CO2浓度的2倍,故2c(CO2,甲)>c(CO2 ,乙),D错误。正确答案为BC。


科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、R、T的原子半径与原子序数关系如下图所示。R原子最外层电子数是电子层数的2倍,Y与Z能形成Z2Y、Z2Y2型离子化合物,Z与T形成的化合物Z2T能破坏水的电离平衡。下列推断正确的是

A. 原子半径和离子半径均满足:Y<Z
B. 氢化物的沸点不一定是:Y>R
C. 最高价氧化物对应水化物的酸性:T<R
D. 由X、R、Y、Z四种元素组成的化合物水溶液一定显碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】单质碘在水中的溶解度较小,且溶解较慢。实验室配制碘水时,往往将碘单质加入稀KI溶液中。该溶液中存在平衡: ![]() 。该反应的平衡常数K随温度变化规律如图所示。下列说法中,正确的是
。该反应的平衡常数K随温度变化规律如图所示。下列说法中,正确的是

A. 向上述体系中加入CCl4,平衡不移动
B. 25 C时,向上述体系中加入少量I2,平衡向右移动,平衡常数大于680
C. 该反应的平衡常数表达式为
D. 该反应的正反应为放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜及其化合物的用途非常广泛,回答下列问题:
(1)基态铜原子有种不同运动状态的电子,二价铜离子的电子排布式为________。
(2)铜能与类卤素(CN)2反应生成Cu(CN)2 1mol(CN)2分子中含有π键的数目为___________。
(3)CuCl2溶液与乙二胺(H2N-CH2-CH2-NH2)可形成配离子[Cu(En)2]2+(En是乙二胺的简写),结构如图所示,
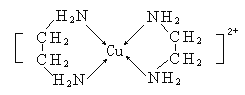
则Cu2+的配位数为_________,该配离子中所含的非金属元素的电负性由大到小的顺序是________;乙二胺分子中氮原子轨道的杂化类型为______,乙二胺和三甲胺[N(CH3)3]均属于胺,但相对分子质量相近,但乙二胺比三甲胺的沸点高的多,原因是__________。
(4)铜晶体中铜原子的堆积方式为面心立方堆积,每个铜原子周围距离最近的铜原子数目为________。
(5)某M原子的外围电子排布是为3s23p5,铜与M形成化合物的晶胞如图所示(黑球代表铜原子)。
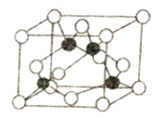
①已知铜和M的电负性分别为1.9和3.0,则铜与M形成的该种化合物属于________ (填“离子”或“共价”)化合物。
②已知该晶体的密度为ρg·cm-3,阿伏加德罗常数为NA,则该晶体中铜原子和M原子之间的最短距离为______pm(只写计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳和硅是自然界中大量存在的元素,硅及其化合物是工业上最重要的材料。粗硅的制备有二种方法:
方法一:SiO2+2C![]() Si+2CO↑ 方法二:SiO2+2Mg
Si+2CO↑ 方法二:SiO2+2Mg![]() Si+2MgO (可能用到的相对原子质量:B-11 P-31)
Si+2MgO (可能用到的相对原子质量:B-11 P-31)
(1)基态硅原子中存在____________对自旋相反的电子,基态Mg的最外层电子所占据的能级的电子云能廓图是________。
(2)上述反应中所有元素第一电离能最小的元素是________(填元素符号)。
(3)试比较C(金刚石),晶体Si,CO三种物质的熔沸点从高到低的顺序___________________,试解释原因:____________________。
(4)CO在配合物中可作为配体,在Cr(CO)6配合物中配原子是________(填元素符号)1mol该配合物中含有π键的数目_________。
(5)SiO2晶跑(如下图)可理解成将金刚石晶胞(如下图)中的C原子置换成Si原子,然后在Si-Si之间插入O原子而形成。


①推测SiO2晶胞中Si采用________杂化,O-Si-O的键角________________。
②SiO2晶跑中,含有Si原子____________个和O原子______________个。
③假设金刚石晶胞的边长为apm,试计算该晶胞的密度_________g/cm3(写出表达式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种可连续使用的锂电池结构如图所示,下列有关该电池放电时的说法正确的是

A. 电子由Li电极经Li+透过膜进入Fe2+、Fe3+的水溶液移向Ti电极
B. Ti电极上发生的电极反应为:Fe3+ + e- = Fe2+
C. Li+透过膜除允许Li+通过外,还允许H2O分子通过
D. 贮罐中发生的离子反应为:S2O82- + 2Fe3+ = 2Fe2+ + 2SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学组装了如右图所示的电化学装置,电极Ⅰ为 Zn,电极Ⅱ为Cu,其他电极均为石墨,则下列说法正确的是
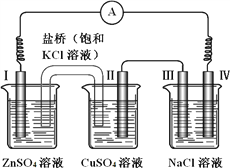
A. 电流方向:电极Ⅳ → ○ → 电极Ⅰ
B. 盐桥中的K+会移向ZnSO4溶液
C. III处得到气体2.24L,电极II上析出6.4g固体
D. NaCl溶液中,电极Ⅲ制得氯气,电极Ⅳ制得金属钠
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com