
【题目】某同学组装了如右图所示的电化学装置,电极Ⅰ为 Zn,电极Ⅱ为Cu,其他电极均为石墨,则下列说法正确的是
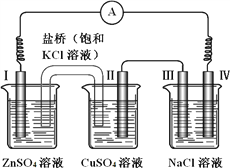
A. 电流方向:电极Ⅳ → ○ → 电极Ⅰ
B. 盐桥中的K+会移向ZnSO4溶液
C. III处得到气体2.24L,电极II上析出6.4g固体
D. NaCl溶液中,电极Ⅲ制得氯气,电极Ⅳ制得金属钠
 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案科目:高中化学 来源: 题型:
【题目】一定温度下,在三个等体积的恒容密闭容器中,反应2CO2(g)+6H2(g) ![]() C2H5OH(g)+3H2O(g)达平衡,下列说法正确的是
C2H5OH(g)+3H2O(g)达平衡,下列说法正确的是
容器 | 温度/K | 物质的起始浓度(mol/L) | 物质的平衡浓度(mol/L) | |||
CO2(g) | H2(g) | C2H5OH(g) | H2O(g) | C2H5OH(g) | ||
甲 | 500 | 0.20 | 0.60 | 0 | 0 | 0.083 |
乙 | 500 | 0.40 | 1.20 | 0 | 0 | |
丙 | 600 | 0 | 0 | 0.10 | 0.30 | 0.039 |
A. 该反应正反应为吸热反应
B. 达平衡时,容器甲中的逆反应速率比容器乙中的小
C. 达平衡时,转化率:α(CO2 ,甲)+α(C2H5OH ,丙)>1
D. 达平衡时,甲、乙容器内:2c(CO2 ,甲)<c(CO2 ,乙)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.丁达尔效应可用于鉴别胶体和溶液
B.胶体粒子的直径在1~100 nm之间
C.胶体一定是混合物
D.将FeCl3稀溶液溶于冷水即可制得Fe(OH)3胶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作、现象以及原因完全对应的是
实验操作 | 实验现象 | 原因 | |
A | 室温下,向浓度均为0.01mol·L-1的BaCl2和CaCl2混合溶液中滴加Na2SO4溶液 | 出现白色沉淀 | Ksp(BaSO4)< Ksp(CaSO4) |
B | 将水蒸气通过灼热的铁粉 | 铁粉变为红色 | 铁可以与水在高温下发生反应 |
C | 向淀粉水解的产物中加入新制的银氨溶液 | 没有出现银镜现象 | 催化剂与新制的银氨溶液发生了反应 |
D | 相同温度下,将相同大小钠块分别加到水、醋酸、乙醇中 | 生成氢气的速率:醋酸>水>乙醇 | 三种电解质电离H+能力:醋酸>水>乙醇 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数,下列说法正确的是
A. 1 mol氦气中有2NA个氦原子
B. 2 L 0.3 mol·L-1Na2SO4溶液中含0.6NA个Na+
C. 14 g氮气中含NA个氮原子
D. 18 g水中所含的电子数为8NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中的一定量混合气体发生反应:x A(g) + yB(g) ![]() z C(g),平衡时测得A的浓度为0.50mol/L,保持温度不变,将容器的容积扩大到原来的2倍,再达平衡时,测得A的浓度为0.30mol/L。下列有关判断正确的是( )
z C(g),平衡时测得A的浓度为0.50mol/L,保持温度不变,将容器的容积扩大到原来的2倍,再达平衡时,测得A的浓度为0.30mol/L。下列有关判断正确的是( )
A. x+y>z B. 平衡向正反应方向移动 C. B的转化率升高 D. C的体积分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于浓硝酸和浓硫酸的叙述,正确的是( )
A.露置在空气中,容器内酸液的质量减轻
B.浓硫酸能与甲烷反应
C.常温下都能用铝制容器贮存
D.在面包实验中浓硫酸只体现脱水性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.镓(Ga)位于周期表的第四周期,与Al同主族,主要存在Ga3+、GaO2-两种离子形式,被广泛应用于电子工业。
(1)用铝粉和Fe2O3做铝热反应实验,需要的试剂还有__________________。
a.KClO3 b. KCl c. MnO2 d. Mg
(2)半导体材料氮化镓由Ga与NH3在一定条件下发生置换反应生成。该过程每生成1molGaN(s)放出热量15.4kJ。镓在周期表中的序号_____________,写出该反应的热化学方程式_________________。
(3)工业上用电解法精炼镓。具体原理如图所示,已知:金属的活动性Zn>Ga>Fe>Cu

①电解精炼镓一段时间后形成的阳极泥主要有______________
②已知精炼时阴极反应:GaO2-+3e-+2H2O=Ga+4OH- 。阳极的电极反应方程式:___________________________________;
Ⅱ.用废铁皮制取铁红(Fe2O3)的部分流程示意图如下:

(4)步骤I温度不能过高。因为:_______________________________。
(5)步骤II中发生反应4Fe(NO3)2+O2+(2n+4)H2O=2Fe2O3·nH2O+8HNO3,生成的硝酸又将废铁皮中的铁转化为Fe(NO3)2。
写出后者反应的离子方程式______________________________________。
(6)上述生产流程中,能体现“绿色化学”思想的是______________________ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com