
【题目】下列关于浓硝酸和浓硫酸的叙述,正确的是( )
A.露置在空气中,容器内酸液的质量减轻
B.浓硫酸能与甲烷反应
C.常温下都能用铝制容器贮存
D.在面包实验中浓硫酸只体现脱水性
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】一种可连续使用的锂电池结构如图所示,下列有关该电池放电时的说法正确的是

A. 电子由Li电极经Li+透过膜进入Fe2+、Fe3+的水溶液移向Ti电极
B. Ti电极上发生的电极反应为:Fe3+ + e- = Fe2+
C. Li+透过膜除允许Li+通过外,还允许H2O分子通过
D. 贮罐中发生的离子反应为:S2O82- + 2Fe3+ = 2Fe2+ + 2SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学组装了如右图所示的电化学装置,电极Ⅰ为 Zn,电极Ⅱ为Cu,其他电极均为石墨,则下列说法正确的是
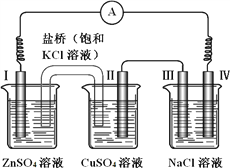
A. 电流方向:电极Ⅳ → ○ → 电极Ⅰ
B. 盐桥中的K+会移向ZnSO4溶液
C. III处得到气体2.24L,电极II上析出6.4g固体
D. NaCl溶液中,电极Ⅲ制得氯气,电极Ⅳ制得金属钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用0.10mol·L-1NaOH溶液分别滴定20.00mL浓度均为0.10 mol·L-1的CH3COOH 溶液和HCN溶液所得滴定曲线如图所示。下列说法正确的是
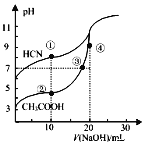
A. 当加入10mLNaOH时:c(CH3COOH)>c(HCN)
B. 点③和点④所示溶液中:c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
C. 已知室温下某碱AOH的Kb=1×10-9,则ACN的水溶液呈碱性
D. 点②和点③所示溶液中都有:c(CH3COO-)+c(OH-)=c(CH3COOH)+c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.ⅥA族元素中氢化物最稳定的其沸点一定最高
B.醋酸铵是含有极性键的共价化合物
C.离子化合物中不可能含有非极性共价键
D.二氯甲烷分子为正四面体结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学家一直致力于对化学反应进行的方向、限度和速率进行研究,寻找合适理论对其进行解释。
I.为了治理汽车尾气污染(含有NO、CO、烃类等),科学家设计在汽车排气管上装上催化剂发生如下反应:2NO(g)+2CO(g)![]() N2(g)+2CO2(g)。某温度下,向体积为1L的密闭容器中充入NO、CO各0.1mol,平衡时NO的转化率为60%,计算该反应的平衡常数K=______________;此反应常温下能够自发进行的原因是_______________________。
N2(g)+2CO2(g)。某温度下,向体积为1L的密闭容器中充入NO、CO各0.1mol,平衡时NO的转化率为60%,计算该反应的平衡常数K=______________;此反应常温下能够自发进行的原因是_______________________。
Ⅱ.右图是高锰酸钾酸性溶液与草酸发生反应的有关图象,溶液体积为500mL。
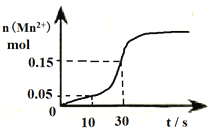
(1)该反应在10-30s的化学反应速率v(Mn2+)=________________________。
(2)请写出该反应的离子方程式____________________________________________________。
(3)观察图象说明在一定温度下反应速率起始缓慢然后加快的原因______________________。
Ⅲ. 难溶电解质FeS在水溶液中存在着溶解平衡:FeS(s)![]() Fe2+(aq) + S2-(aq),在一定温度下,Ksp=c(Fe2+)·c(S2-)=6.25×10-18;在该温度下,氢硫酸饱和溶液中存在c2(H+)· c(S2-)=1.0×10-22。将适量FeCl2投入氢硫酸饱和溶液中,欲使溶液中c(Fe2+)=1.0 mol·L-1,应调节溶液的c(H+)=_______。
Fe2+(aq) + S2-(aq),在一定温度下,Ksp=c(Fe2+)·c(S2-)=6.25×10-18;在该温度下,氢硫酸饱和溶液中存在c2(H+)· c(S2-)=1.0×10-22。将适量FeCl2投入氢硫酸饱和溶液中,欲使溶液中c(Fe2+)=1.0 mol·L-1,应调节溶液的c(H+)=_______。
IV.氢硫酸中H2S是分步电离的,H2S![]() H+ + HS- K1=1.3×10-7,HS-
H+ + HS- K1=1.3×10-7,HS-![]() H+ + S2- K2=7.1×10-15欲使溶液中c(S2-)浓度增大,应采取的措施有_____________。
H+ + S2- K2=7.1×10-15欲使溶液中c(S2-)浓度增大,应采取的措施有_____________。
A.加入NaOH B.加入CuSO4 C.适当降低温度 D.通入过量SO2 E.加入Na2CO3 (H2CO3电离常数K1=4.4×10-7,K2=4.7×10-11)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄血盐[亚铁氰化钾,K4Fe(CN)6]目前广泛用做食盐添加剂(抗结剂),制备黄血盐的一种工艺如下:

回答下列问题:
(1)实验室用绿矾晶体配制硫酸亚铁溶液时,为了防止其变质需要添加的试剂为__________________。
(2)步骤Ⅱ中滤渣的主要成分是_______________,步骤Ⅴ所用的试剂X可以是________________。
(3)步骤Ⅲ反应的化学方程式为_______________________________________。
(4)工艺中用到剧毒的HCN溶液,含CN-的废水必须处理后才能排放。25℃时,Ka(HCN) =6.25×10-10。
①HCN的电子式为__________________。
②25℃时,反应CN-+H2O![]() HCN+OH-的平衡常数K=_____________________。
HCN+OH-的平衡常数K=_____________________。
③含CN-废水的处理方法之一是:pH控制在11左右,用氯气将废水中CN-氧化成CO2和N2,该反应的离子方程式为_____________________________________。
(5)近日,一条“盐里面加进了亚铁氰化钾”危害身体健康的信息在网上流传。已知K4Fe(CN)6![]() 4KCN+FeC2+N2↑,氰化钾的半数致死量(LD50)为6.4 mg·kg-1 (即每1kg体重6.4 mg),我国卫生部规定食盐中黄血盐的最大使用量为10 mg·kg-1。假设烹饪过程中黄血盐发生上述分解,一名60Kg男子每天摄入60g食盐是否达到氰化钾的半数致死量?_________________________________。(列式计算说明)。
4KCN+FeC2+N2↑,氰化钾的半数致死量(LD50)为6.4 mg·kg-1 (即每1kg体重6.4 mg),我国卫生部规定食盐中黄血盐的最大使用量为10 mg·kg-1。假设烹饪过程中黄血盐发生上述分解,一名60Kg男子每天摄入60g食盐是否达到氰化钾的半数致死量?_________________________________。(列式计算说明)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com