
【题目】下列过程属于放热反应的是( )
A.Ba(OH)2·8H2O与NH4Cl的反应B.浓硫酸的稀释
C.碳酸钙高温分解D.盐酸和氢氧化钠溶液的反应
科目:高中化学 来源: 题型:
【题目】I(化学反应原理)
(1)25℃,100 mL氢氧化钡溶液中含有1×10-3 mol的OH-,该溶液的pH为_________。
(2)常温下,CuCl2的水溶液呈_____(填“酸”、“中”或“碱”)性,原因是_______________(用离子方程式表示)。
(3)把AlCl3溶液在空气中蒸干、灼烧,最后得到的主要固体产物是_________。
(4)等体积等物质的量浓度的醋酸和氢氧化钠溶液混合后,溶液中
c(Na+)________c(CH3COO-)(填“ >”、“=”或“<” )。
II(化学与生活)
有四种常见药物 ①阿司匹林 ②青霉素 ③胃舒平 ④麻黄碱.请回答:
(1)某同学胃酸过多,应选用的药物是______(填序号),抗酸药是治疗胃酸过多的一类药品,请写出一种抗酸药(有效成分是碳酸钙)中和胃酸过多的化学反应方程式:___________________________。
(2)由于具有兴奋作用,国际奥委会严禁运动员服用的药物是_________(填序号)。
(3)从用药安全角度考虑,使用前要进行皮肤敏感性测试的药物是_______(填序号)。
(4)滥用药物会导致不良后果,如过量服用________(填序号)会出现水杨酸中毒,应立即停药,并静脉注射___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各选项有机物数目,与分子式为ClC4H7O2且能与碳酸氢钠反应生成气体的有机物数目相同的是(不含立体异构)( )
A. 分子式为C5H10的烯烃
B. 分子式为C4H8O2的酯
C. 甲苯( )的一氯代物
)的一氯代物
D. 立体烷( )的二氯代物
)的二氯代物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2是一种优良的消毒剂,常将其制成NaClO2固体,以便运输和贮存,过氧化氢法备NaClO2固体的实验装置如图所示。
已知:①2NaC1O3+H2O2+H2SO4=2C1O2↑+O2↑+Na2SO4+2H2O
2ClO2+H2O2+2NaOH=2NaClO2+O2↑+2H2O
②ClO2熔点-59℃、沸点11℃,浓度过高时易发生分解;
③H2O2沸点150℃
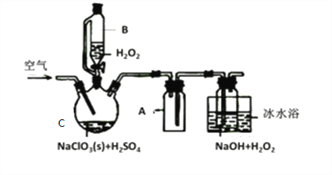
(1)仪器C的名称是__________________,仪器A的作用是_________________,冰水浴冷却的目的是_____________________和___________________________。
(2)该装置不完善的方面是________________________。
(3)空气流速过快或过慢,均降低NaClO2产率,试解释其原因,空气流速过慢时,___________;空气流速过快时,________________。
(4)Cl-存在时会催化ClO2的生成。反应开始时在C中加入少量盐酸,ClO2的生成速率大大提高,并产生微量氯气。该过程可能经两步完成,请将其补充完整:
①_____________________________(用离子方程式表示)
②H2O2+Cl2=2Cl-+O2+2H+
(5)NaClO2纯度测定:
①准确称取所得NaClO2样品10.0g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(C1O2-的产物为Cl-),将所得混合液配成250mL待测溶液;
②取25.00mL待测液,用2.0mol·L-1Na2S2O3标准液滴定(I2+2S2O32-=2I-+S4O62-),以淀粉溶液做指示剂,达到滴定终点时的现象为__________________________,重复滴定3次,测得Na2S2O3标准液平均用量为20.00mL,则该样品中NaClO2的质量分数为_________________。(M(NaClO2)=90.5g/mol)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在三个等体积的恒容密闭容器中,反应2CO2(g)+6H2(g) ![]() C2H5OH(g)+3H2O(g)达平衡,下列说法正确的是
C2H5OH(g)+3H2O(g)达平衡,下列说法正确的是
容器 | 温度/K | 物质的起始浓度(mol/L) | 物质的平衡浓度(mol/L) | |||
CO2(g) | H2(g) | C2H5OH(g) | H2O(g) | C2H5OH(g) | ||
甲 | 500 | 0.20 | 0.60 | 0 | 0 | 0.083 |
乙 | 500 | 0.40 | 1.20 | 0 | 0 | |
丙 | 600 | 0 | 0 | 0.10 | 0.30 | 0.039 |
A. 该反应正反应为吸热反应
B. 达平衡时,容器甲中的逆反应速率比容器乙中的小
C. 达平衡时,转化率:α(CO2 ,甲)+α(C2H5OH ,丙)>1
D. 达平衡时,甲、乙容器内:2c(CO2 ,甲)<c(CO2 ,乙)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 焰火的五彩缤纷是某些金属元素化学性质的展现
B. Na2O中阴、阳离子的个数比为1∶1
C. 向氯化铝溶液中加入过量氨水反应的实质是Al3++3NH3·H2O===Al(OH)3↓+3NH![]()
D. 将等物质的量的氧化钠和过氧化钠分别投入到足量且等质量的水中,得到溶质质量分数分别是a%和b%的两种溶液,则a和b的关系是a<b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物在工农业生产、生活中有着重要应用。
雾霾天气严重影响人们的生活,其中氮氧化物(NOx)是形成雾霾天气的重要因素。
(1)已知①N2(g)+O2(g)=2NO(g) △H=+181.5 kJ·mol-1
②C(s)+O2(g)=CO2(g) △H=-392.5 kJ·mol-1
③2C(s)+O2(g)=2CO(g) △H=-221 kJ·mol-1
请写出NO与CO反应的热化学方程式___________________________。
(2)用活性炭还原法可以消除NO 的污染,发生的反应为C(s)+2NO(g)![]() N2(g)+CO2(g)。1molNO 和足量的活性炭在T℃、容积恒定为2L的密闭容器中反应,经过5min反应达到平衡,测得NO的物质的量为 0.4mol。
N2(g)+CO2(g)。1molNO 和足量的活性炭在T℃、容积恒定为2L的密闭容器中反应,经过5min反应达到平衡,测得NO的物质的量为 0.4mol。
①从反应开始到5min,用氮气表示的平均反应速率为_________。达到平衡后,向容器中再通入0.1molNO气体和0.3molCO2气体,则此平衡将_________(填“正向移动”“不移动”或“逆向移动”)。
②能判断该反应一定达到化学平衡状态的依据是_________(填标号)。
a.NO和N2的体积比保持不变
b.单位时间内生成2nmolNO的同时消耗nmolCO2
c.恒温恒容条件下,反应体系的压强不再发生改变
d.恒容条件下,混合气体的平均相对分子质量不变
(3)N2O4 与NO2之间存在反应,N2O4(g)![]() 2NO2(B) △H=QkJ·mol-1。将一定量的N2O4放入恒容密闭容器中,测得其平衡转化率[a(N2O4)] 随温度变化如图所示。
2NO2(B) △H=QkJ·mol-1。将一定量的N2O4放入恒容密闭容器中,测得其平衡转化率[a(N2O4)] 随温度变化如图所示。

如图中a点对应温度下,已知N2O4的起始压强P0为220kPa,该温度下反应的平衡常数Kp=_________ (小数点后保留两位数字,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(4)硝酸银溶液和连二次硝酸钠溶液混合,可以得到黄色的连二次硝酸银沉淀,向该分散系中滴加硫酸钠溶液,当白色沉淀和黄色沉淀共存时,分散系中C(NO22-)/C(SO42-)
=_________。【己知Ksp(Ag2N2O2)=4.2×10-9,Ksp(Ag2SO4)=1.4×10-5】
(5)用石墨为电极,利用如图电解装置可将雾霾中的NO、SO2分别转化为NH4+和SO42-,则阴极的电极反应式是____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数,下列说法正确的是
A. 1 mol氦气中有2NA个氦原子
B. 2 L 0.3 mol·L-1Na2SO4溶液中含0.6NA个Na+
C. 14 g氮气中含NA个氮原子
D. 18 g水中所含的电子数为8NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com