
【题目】25℃时,水的电离达到平衡:H2O![]() H+ + OH-,下列叙述正确的是
H+ + OH-,下列叙述正确的是
A. 向水中加入稀氨水,平衡逆向移动,c(OH-)降低
B. 向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变
C. 向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低
D. 将水加热,Kw增大,pH不变
 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案科目:高中化学 来源: 题型:
【题目】下列物质的分离方法不正确的是( )
A.用过滤的方法除去食盐水中的泥沙
B.用蒸馏的方法将自来水制成蒸馏水
C.用酒精萃取碘水中的碘
D.用淘洗的方法从沙里淘金
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1.5 mol Cu2S和足量稀HNO3反应,生成Cu(NO3)2、H2SO4、NO和H2O。则参加反应的硝酸中被还原的硝酸的物质的量是
A. 5 mol B. 1.5 mol C. 6 mol D. 1mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.丁达尔效应可用于鉴别胶体和溶液
B.胶体粒子的直径在1~100 nm之间
C.胶体一定是混合物
D.将FeCl3稀溶液溶于冷水即可制得Fe(OH)3胶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合物A,含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下可实现下图所示的物质之间的变化:
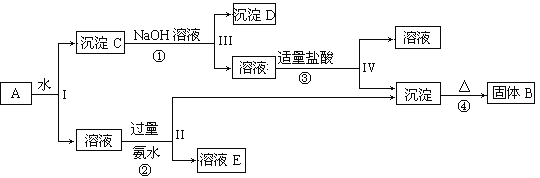
据此回答下列问题:
(1)I、II、III、IV四步中分离溶液和沉淀所采取的操作名称是____________。
(2)①、③反应的离子方程式:
①_____________________________________________________________;
③_____________________________________________________________。
(3)有人认为③用盐酸不是太好,改为通入足量的一种气体,这种气体为______。该离子反应方程式为:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物(NH4)xFey(SO4)m是一种重要的化工原料。某实验小组为探究该物质的组成,进行如下实验:
(1)探究铁元素化合价
A.甲同学认为铁可能只有+3价;
B.乙同学认为铁可能只有+2价;
C.丙同学认为铁的化合价________________________________。
请设计实验,证明丙同学的结论:______________________________________。
(2)三位同学通过实验证明,铁的化合价为+2价。为了进一步探究该化合物的组成,设计了如下实验:
①准确称取4.36g样品,配制成100.00mL溶液A;
②准确量取20.00mL溶液A,用0.0200 mol·L-1的酸性KMnO4标准溶液滴定其中的Fe2+离子,消耗标准溶液的体积为40.00 mL;
③测定NH4+的含量;另取20.00mL溶液A,加入足量的NaOH溶液并充分加热,用100mL0.10 mol/L的稀盐酸吸收,再用0.10mol/LNaOH标准溶液滴定吸收液,消耗NaOH的体积为60mL。
Ⅰ.写出步骤②中发生的离子方程式__________________________________。
Ⅱ.步骤③中,加入NaOH溶液发生的化学反应方程式______________________________;加入的指示剂是_____________________,判断滴定终点的现象为_____________________,若滴定管在使用前未用NaOH标准溶液润洗,测得的NH4+含量将_____________(填“偏高”、“偏低”或“不变”)。Ⅲ. (NH4)xFey(SO4)m的化学简式为_________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com