
| A、+6 | B、+4 | C、+2 | D、-2 |
科目:高中化学 来源: 题型:
压强/MPa 体积分数/% 温度/℃ | 1.0 | 2.0 | 3.0 |
| 810 | 54.0 | a | b |
| 915 | c | 75.0 | d |
| 1000 | e | f | 83.0 |
| A、①② | B、④③ | C、①③ | D、②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将pH=5的盐酸稀释100倍所得溶液 |
| B、c(H+)=c(OH-)=1×10-6mol/L的溶液 |
| C、由强酸、强碱等物质的量反应得到的溶液 |
| D、非电解质溶于水得到的溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
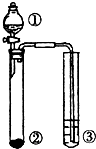 利用图示实验装置,能达到实验目标的是( )
利用图示实验装置,能达到实验目标的是( )| ① | ② | ③ | 实验目标 | |
| A | 浓盐酸 | MnO2 | 滴有少量KSCN的FeCl2溶液 | 验证FeCl2的还原性 |
| B | 浓氨水 | 生石灰 | AlCl3溶液 | 验证Al(OH)3的两性 |
| C | H2O | 金属钠 | 乙醛溶液 | 验证乙醛能与氢气发生加成反应 |
| D | 硫酸 | Na2CO3 | Na2SiO3溶液 | 验证非金属性:S>C>Si |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、分子组成相差一个或若干个CH2的有机物互称为同系物 |
| B、分子式相同而结构不同的有机物必定是同分异构体 |
| C、若A与B互为同系物,则A、B必符合同一个通式 |
| D、同系物之间不可能是同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
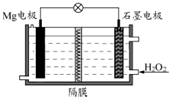 Mg-H2O2电池可用于驱动无人驾驶的潜航器.该电池以海水为电解质溶液,示意图如下.该电池工作时,下列说法正确的是( )
Mg-H2O2电池可用于驱动无人驾驶的潜航器.该电池以海水为电解质溶液,示意图如下.该电池工作时,下列说法正确的是( )| A、Mg 电极是该电池的正极 |
| B、H2O2在石墨电极上发生还原反应 |
| C、石墨电极附近溶液的pH 减小 |
| D、溶液中Cl-向正极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,1.12L 16O2和1.12L 18O2均含有0.1NA个氧原子 |
| B、第三周期非金属元素含氧酸的酸性从左到右依次增强 |
| C、能使甲基橙显红色的溶液中大量存在:Mg2+、Fe2+、Cl-、NO3- |
| D、从C(石墨)═C(金刚石);△H=+1.9kJ?mol-1,可知金刚石比石墨更稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
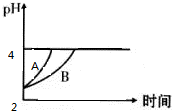 化学学科中存在以下四种平衡体系:化学平衡、电离平衡、水解平衡和溶解平衡,且均符合勒夏特列原理.请回答下列问题:
化学学科中存在以下四种平衡体系:化学平衡、电离平衡、水解平衡和溶解平衡,且均符合勒夏特列原理.请回答下列问题:| CO | 2- 3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com