
已知离子方程式:As2S3+H2O+NO3-→AsO43—+SO42—+NO↑+H+(未配平),下列说法错误的是
A.配平后水的化学计量数为4
B.反应后溶液呈酸性
C.配平后氧化剂与还原剂的物质的量之比为3∶28
D.氧化产物为AsO43—和SO42—
 孟建平错题本系列答案
孟建平错题本系列答案 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案科目:高中化学 来源:2015-2016学年黑龙江大庆铁人中学高二上9月考化学试卷(解析版) 题型:填空题
(16分)如图所示装置,回答下列问题:
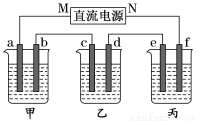
a、b、c、e、f均为石墨电极,甲、乙、丙三个烧杯依次分别盛放足量的NaOH溶液、足量的CuSO4溶液和足量含有酚酞的K2SO4溶液.
(1)通电进行电解,发现丙中f极先变红色。
①直流电源的M极是 (填“正极”或“负极”)
②请写出甲池a 电极上的电极反应式:
③甲池电解过程中溶液的pH (填“增大”或“减小”),原因是:
④如果导线中通过4mol电子,则丙中溶液质量 (填“增大”或“减小”) g
(2)若用丙装置在铁上镀铜,需要将丙装置进行改装,则e应该是 (填“铁”或“铜”),电镀液是 溶液,电镀过程中电镀液的浓度 (填“增大”、“减小”或“不变”)。
(3)若用丙装置对铁的腐蚀进行防护, (填e或f)为铁电极,该防护方法称为__________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年辽宁育才学校高一上第一次阶段测化学试卷(解析版) 题型:选择题
在无色透明酸性溶液中,能大量共存的离子组是
A.Mg2+、NO3-、Cl、Na+ B.K+、SO42-、HCO3-、Na+
C.NH4+、NO3-、Al3+、CH3COO D.MnO4-、K+、SO42-、Na+
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东寿光中学高二上10月月考化学试卷(解析版) 题型:选择题
下列与金属腐蚀有关的说法正确的是
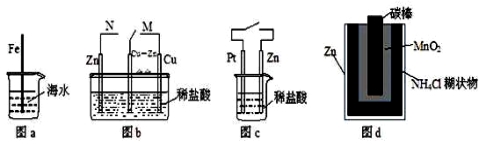
A.图a中,插入海水中的铁棒,越靠近底端腐蚀越严重
B.图b中,开关由M改置于N时,Cu-Zn合金的腐蚀速率减小
C.图c中,接通开关时Zn腐蚀速率增大,Zn上放出气体的速率也增大
D.图d中,Zn-MnO2干电池自放电腐蚀主要是由MnO2的氧化作用引起的
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东寿光中学高一上10月月考化学试卷(解析版) 题型:选择题
在标准状况下,100mL 某气体的质量为0.125g,则该气体可能是下列中的
A.氨气 B.氮气 C.二氧化碳 D.氢气
查看答案和解析>>
科目:高中化学 来源:2016届河北省高三上学期四调考试化学试卷(解析版) 题型:选择题
下列叙述正确的是
A.氯化铵、次氯酸钠、醋酸铵、硫酸钡都是强电解质
B.电解、电泳、电离、电化学腐蚀均需在通电条件下才能进行
C.红宝石、水晶、钻石的主要成分都是二氧化硅
D.福尔马林、水玻璃、氨水、胆矾均为混合物
查看答案和解析>>
科目:高中化学 来源:2015-2016学年甘肃省高一上期中测试化学试卷(解析版) 题型:选择题
某化合物易溶于水,但其水溶液不导电,则该化合物是
A.弱电解质 B.强电解质 C.非电解质 D.不能确定其类型
查看答案和解析>>
科目:高中化学 来源:2016届吉林省长春市高三上学期期中测试化学试卷(解析版) 题型:推断题
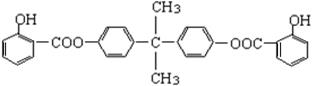
(共15分)利用芳香烃X和烯烃Y可以合成紫外线吸收剂BAD。
已知:G不能发生银镜反应,B遇FeCl3溶液显紫色,C到D的过程为引入羧基(—COOH)的反应。其中BAD结构简式为:
BAD的合成路线如下:
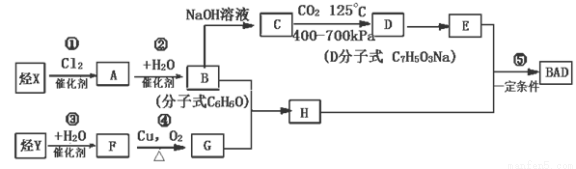
试回答下列问题:
(1)写出结构简式:Y ,D 。
(2)上述属于取代反应的有 (填数字序号)。
(3)1molBAD最多可与含 molNaOH的溶液完全反应。
(4)写出下列反应的化学方程式,注明反应条件:反应④
B+E
(5)E有多种同分异构体,判断符合下列要求的同分异构体数目为 种。
①能发生银镜反应 ②遇FeCl3溶液显紫色 ③核磁共振氢谱图中有四个吸收峰
查看答案和解析>>
科目:高中化学 来源:2016届贵州省高三上学期第二次月考理综化学试卷(解析版) 题型:填空题
(14分)工业上可由天然气为原料制备甲醇,也可由水煤气合成甲醇。
(1)已知2CH4(g)+O2(g)=2CO2(g)+4H2(g) △H=akJ/mol
CO(g)+2H2(g)=CH3OH(g)△H=bkJ/mol
试写出由CH4和O2制取甲烷的热化学方程式:___________________。
(2)还可以通过下列反应制备甲醇:CO(g)+2H2(g) CH3OH(g)。图甲是反应时CO(g)和CH3OH(g)的浓度随时间t的变化情况。从反应开始到平衡,用CO表示平均反应速率v(CO)=____________,该反应的平衡常数表达式为______________。
CH3OH(g)。图甲是反应时CO(g)和CH3OH(g)的浓度随时间t的变化情况。从反应开始到平衡,用CO表示平均反应速率v(CO)=____________,该反应的平衡常数表达式为______________。
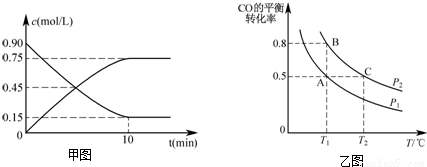
(3)在一容积可变的密闭容器中充入10mol CO和20mol H2,CO的平衡转化率随温度(T)、压强(P)的变化如乙图所示.
①下列说法不能判断该反应达到化学平衡状态的是___________。(填字母)
A.H2的消耗速率等于CH3OH的生成速率的2倍
B.H2的体积分数不再改变
C.体系中H2的转化率和CO的转化率相等
D.体系中气体的平均摩尔质量不再改变
②比较A、B两点压强大小PA___________PB(填“>、<、=”)。
③若达到化学平衡状态A时,容器的体积为20L.如果反应开始时仍充入10molCO和20molH2,则在平衡状态B时容器的体积V(B)=___________L。
(4)以甲醇为燃料,氧气为氧化剂,KOH溶液为电解质溶液,可制成燃料电池(电极材料为惰性电极)。
①若KOH溶液足量,则电池负极反应的离子方程式为_____________。
②若电解质溶液中KOH的物质的量为1.0mol,当有0.75mol甲醇参与反应时,电解质溶液中各种离子的物质的量浓度由大到小的顺序是______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com