
【题目】镧系为元素周期表中第ⅢB族、原子序数为57至71的元素。
(1)镝(Dy)的基态原子电子排布式为[Xe]4f106s2,画出镝(Dy)原子外围电子排布图:_____。
(2)高温超导材料镧钡铜氧化物中含有Cu3+,基态时Cu3+的电子排布式为_______________。
(3)观察下面四种镧系元素的电离能数据,判断最有可能显示+3价的元素是_______(填元素名称)。
几种镧系元素的电离能(单位:kJ·mol-1)
元素 | I1 | I2 | I3 | I4 |
Yb(镱) | 604 | 1217 | 4494 | 5014 |
Lu(镥) | 532 | 1390 | 4111 | 4987 |
La(镧) | 538 | 1067 | 1850 | 5419 |
Ce(铈) | 527 | 1047 | 1949 | 3547 |
(4)元素铈(Ce)可以形成配合物(NH4)2[Ce(NO3)6]。
①组成配合物的四种元素,电负性由大到小的顺序为_______________(用元素符号表示)。
②元素Al也有类似成键情况,气态氯化铝分子表示为(AlCl3)2,分子中Al 原子杂化方式为________,分子中所含化学键类型有______________(填字母)。
a.离子键 b.极性键 C.非极性键 d.配位键
(5)PrO2(二氧化镨)的晶体结构与CaF2相似,晶胞中镨原子位于面心和顶点,则PrO2(二氧化镨)的晶胞中有______个氧原子;已知晶胞参数为a pm,密度为ρg·cm-3,NA=________ (用含a、ρ的代数式表示)。
【答案】![]() [Ar]3d8(或1s22s22p63s23p63d8) 镧 O>N>H>Ce sp3 bd 8
[Ar]3d8(或1s22s22p63s23p63d8) 镧 O>N>H>Ce sp3 bd 8 ![]()
【解析】
(1)根据镝(Dy)的基态原子电子排布式为[Xe]4f106s2可知,镝原子外围4f能级上有10个电子,6s能级上有2个电子,则其外围电子排布图:![]() 。
。
(2)铜是29号元素,基态原子的电子排布式为[Ar]3d104s1,高温超导材料镧钡铜氧化物中含有Cu3+,说明铜失去3个电子,则基态时Cu3+的电子排布式为[Ar]3d8(或1s22s22p63s23p63d8)。
(3)第三电离能与第一电离能、第二电离能相差越小,第三个电子越容易失去,+3价可能性越大,在上述表中,镧的I1、I2、I3最接近,则最有可能显示+3价的元素是镧。
(4)①元素铈(Ce)可以形成配合物(NH4)2[Ce(NO3)6],组成配合物的四种元素中,因元素非金属性越强,电负性越大,则O>N>H,又因Ce是金属,其电负性在四种元素中最小。
②气态氯化铝分子中,每个Al原子与4个Cl原子形成4个δ键,则Al原子的杂化方式为sp3,在该分子中,与Al原子形成极性共价键的两个Cl原子中,有一个是配位键。
(5)PrO2(二氧化镨)的晶体结构与CaF2相似,晶胞中镨原子位于面心和顶点,所以晶胞中镨原子的个数为6×1/2+8×1/8=4,则氧原子的个数为4×2=8。
(1)根据镝(Dy)的基态原子电子排布式为[Xe]4f106s2可知,镝原子外围4f能级上有10个电子,6s能级上有2个电子,则其外围电子排布图:![]() ,故答案为:
,故答案为:![]() 。
。
(2)铜是29号元素,基态原子的电子排布式为[Ar]3d104s1,高温超导材料镧钡铜氧化物中含有Cu3+,说明铜失去3个电子,则基态时Cu3+的电子排布式为[Ar]3d8(或1s22s22p63s23p63d8),故答案为:[Ar]3d8(或1s22s22p63s23p63d8)。
(3)第三电离能与第一电离能、第二电离能相差越小,第三个电子越容易失去,+3价可能性越大,在上述表中,镧的I1、I2、I3最接近,则最有可能显示+3价的元素是镧,故答案为:镧。
(4)①元素铈(Ce)可以形成配合物(NH4)2[Ce(NO3)6],组成配合物的四种元素中,因元素非金属性越强,电负性越大,则O>N>H,又因Ce是金属,其电负性在四种元素中最小,所以电负性大小顺序为:O>N>H>Ce,故答案为:O>N>H>Ce。
②气态氯化铝分子中,每个Al原子与4个Cl原子形成4个δ键,则Al原子的杂化方式为sp3,在该分子中,与Al原子形成极性共价键的两个Cl原子中,有一个是配位键,氯原子提供电子,Al原子提供空轨道,故答案为:sp3;bd。
(5)PrO2(二氧化镨)的晶体结构与CaF2相似,晶胞中镨原子位于面心和顶点,所以晶胞中镨原子的个数为6×1/2+8×1/8=4,则氧原子的个数为4×2=8;根据上述分析可知,一个二氧化镨晶胞中含有4个PrO2,则ρ=n×M/V=(4/NA)×173/(a×10-10)3,则NA=![]() ,故答案为:8;
,故答案为:8;![]() 。
。


 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案科目:高中化学 来源: 题型:
【题目】营养专家认为菠菜中铁的含量较高,缺铁性贫血患者多食用菠菜,对疾病的治疗有一定的疗效。你认为菠菜所影响的缺铁性贫血患者合成的化合物名称,及最终决定菠菜含铁量较高的化合物分别是( )
A. 血浆蛋白、核酸 B. 血红蛋白、核酸 C. 血浆蛋白、载体 D. 血红蛋白、载体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能证明苯酚具有弱酸性的实验是( )
A.加入浓溴水生成白色沉淀
B.苯酚钠溶液中通入CO2后,溶液由澄清变浑浊
C.苯酚的浑浊液加热后变澄清
D.苯酚的水溶液中加NaOH溶液,生成苯酚钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示细胞内某些有机物的元素组成和功能关系,其中A、B代表元素,Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ是生物大分子,图中X、Y、Z、P分别为构成生物大分子的基本单位。请回答下列问题:

(1)A、B分别是________、________。
(2)如果Ⅰ是人和动物细胞的主要能源物质,则X的名称是________。
(3)P经________方式形成Ⅳ,连接两个P的化学键的结构简式是________。Ⅳ多种多样,从P分析原因是____________________。
(4)大分子物质Ⅰ~Ⅴ中,具有物种特异性的是________。
(5)由小分子物质X、Y、Z、P生成大分子物质Ⅰ、Ⅱ、Ⅲ、Ⅳ的过程中,有一共同的生成物是________。
(6)相同质量的Ⅴ氧化分解时释放的能量远远多于Ⅰ,原因是Ⅴ中________含量高。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以稀硫酸为电解质溶液,利用太阳能将CO2转化为低碳烯烃,工作原理如图。下列说法正确的是( )
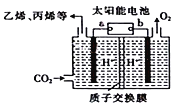
A. a电极为太阳能电池的正极
B. 太阳能电池的原理与原电池的原理相同
C. 产生丙烯的电极反应式为:3CO2+18H++18e—===6H2O+CH3CH=CH2
D. 装置中每转移2mole—,理论上有2molH+通过质子交换膜从左向右扩散
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】孔雀石的主要成分是Cu2(OH)2CO3(含Fe2O3、FeCO3、Al2O3、SiO2杂质),工业上用孔雀石制备硫酸铜的第一步需用过量的硫酸溶解并过滤。常温下,分别取滤液并向其中加入指定物质,反应后的溶液中大量存在的离子组正确的是
A. 加入过量氨水:Fe3+、NH4+、SO42-、OH-
B. 加入过量NaClO溶液:Fe2+、Na+、ClO-、SO42-
C. 加入过量NaOH溶液:Na+、AlO2-、SO42-、OH-
D. 加入过量NaHCO3溶液:Na+、Al3+、SO42-、HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列是对组成细胞分子的描述,正确的是( )
A. 组成细胞的各种分子都因物种不同而存在结构和功能上的差别
B. 生物大分子都能为细胞的生命活动提供能量
C. 核酸是生物体携带遗传信息的物质
D. 生物体内参与信息传递的信息分子是蛋白质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图所示装置测定中和热的实验步骤如下:

①用量筒量取50mL0.50mol·L-1盐酸倒入小烧杯中,测出盐酸温度;②用另一量筒量取50mL0.55mol·L-1NaOH溶液,并用另一温度计测出其温度;③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液最高温度,回答下列问题:
(1)为什么所用NaOH溶液要稍过量____________________。
(2)倒入NaOH溶液的正确操作是________(填序号)。
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(3)使盐酸与NaOH溶液混合均匀的正确操作是________(填序号)。
A.用温度计小心搅拌
B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯
D.用套在温度计上的环形玻璃搅拌棒轻轻地搅动
(4)现将一定量的稀氢氧化钠溶液、稀氢氧化钙溶液、稀氨水分别和1L1mol·L-1的稀盐酸恰好完全反应,其反应热分别为△H1、△H2、△H3,则△H1、△H2、△H3的大小关系为________。
(5)________(填“能”或“不能”)用Ba(OH)2溶液和硫酸代替氢氧化钠溶液和盐酸,理由是_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com