��������1��a��CH
3OH������������CO���������ʶ���ʾ����Ӧ���ʣ�
b����Ϊ���壬������������䣬�����������������䣬�ܶ���ʼ����Ϊ��ֵ��
c�������������������䣬�淴Ӧ���У����������ܵ����ʵ�����С����ƽ����Է���������С�����Ϊ��ֵ��
d�����淴Ӧ�õ�ƽ�⣬��Ӧ������Ũ�ȡ�����Ϊ��ֵ��
��2�����ɱ������ݿ�֪���¶�Խ�ߣ�ƽ�ⳣ��ԽС��˵�������¶�ƽ�����淴Ӧ�ƶ��������¶�ƽ�������ȷ�Ӧ�ƶ���
��Ҫ���CO��ת���ʣ�ƽ��Ӧ������Ӧ�ƶ����ݴ˽��ѡ������жϣ�ע����ֻ����COŨ�ȣ�ƽ��������Ӧ�ƶ���CO��ת���ʽ��ͣ�
�ۼ���ƽ��ʱCO�����ʵ�����n
��ʼ��CO��-n
ƽ����CO��=n
ת����CO��������ת���ʶ������CO��ת���ʣ�
������¶��µ�ƽ�ⳣ�����Աȱ��������ж��¶ȣ�
����v=
����v��CO����������֮�ȵ��ڻ�ѧ������֮�ȼ���v��CH
3OH����
��3��ѹǿԽ��Ӧ����Խ�죻ƽ�ⳣ��ֻ���¶�Ӱ�죬�¶Ȳ��䣬ƽ�ⳣ�����䣮ƽ����ϵ��H
2����������¶�T
1��T
2ʱ�ĵͣ�˵��T
1��T
2��ȣ�ƽ��������Ӧ�ƶ����÷�Ӧ����ӦΪ���ȷ�Ӧ�����¶�T
1��T
2��
��4��0.5mol�״�������ȫȼ�����ɶ�����̼�����Һ̬ˮ���ų�QKJ���������ݴ˸����Ȼ�ѧ����ʽ��дԭ����д��
��ͼ2�е��������·���ƶ���֪��aΪ������bΪ������ԭ��ظ�������������Ӧ��CH
3OH�ڸ����ŵ磬���������ŵ�����̼�����ˮ��
����⣺��1��a��CH
3OH������������CO���������ʶ���ʾ����Ӧ���ʣ���ʼ���շ�Ӧ���ʶ���1��1���У�����˵������ƽ�⣬��a����
b����Ϊ���壬������������䣬�����������������䣬�ܶ���ʼ����Ϊ��ֵ������˵�����淴Ӧ����ƽ�⣬��b����
c�������������������䣬�淴Ӧ���У����������ܵ����ʵ�����С����ƽ����Է���������С�����Ϊ��ֵ��˵�����淴Ӧ����ƽ��״̬����c��ȷ��
d��CH
3OH��CO��H
2��Ũ�ȶ����ٷ����仯��˵�����淴Ӧ����ƽ��״̬����d��ȷ��
��ѡ��cd��
��2�����ɱ������ݿ�֪���¶�Խ�ߣ�ƽ�ⳣ��ԽС��˵�������¶�ƽ�����淴Ӧ�ƶ��������¶�ƽ�������ȷ�Ӧ�ƶ���������ӦΪ���ȷ�Ӧ������H��0��
�ʴ�Ϊ������
��a�������¶ȣ�ƽ�����淴Ӧ�ƶ���ƽ��ʱCO��ת���ʼ�С����a����
b��������������̵���ƽ��ʱ�䣬ƽ�ⲻ�ƶ���COת���ʲ��䣬��b����
c������CO��Ũ�ȣ�ƽ��������Ӧ�ƶ���ƽ��ʱCO��ת���ʼ�С����c����
d������H
2��ѹ��ƽ��������Ӧ�ƶ���ƽ��ʱCO��ת��������d��ȷ��
e��������������ѹ����Ӧ������Ũ�Ȳ��䣬�仯���ƶ�����e����
f��������״���ƽ��������Ӧ�ƶ���ƽ��ʱCO��ת��������f��ȷ��
��ѡ��df��
��ij�¶��£���2mol CO��6mol H
2����2L���ܱ������У���ַ�Ӧ10min�ﵽƽ��ʱ���c��CO��=0.2mol/L��
ƽ��ʱCO�����ʵ���Ϊ0.2mol/L��2L=0.4mol������CO��ת����Ϊ
��100%=80%��
���ڿ��淴Ӧ��CO��g��+2H
2��g��?CH
3OH��g��
��ʼ��mol/L����1 3 0
�仯��mol/L����0.8 1.6 0.8
ƽ�⣨mol/L����0.2 1.4 0.8
���Ը��¶���ƽ�ⳣ��k=
=2.041��ƽ�ⳣ��ֻ���¶�Ӱ�죬�ʸ��¶�Ϊ250�森
v��CO��=
=0.08mol/��L?min��������֮�ȵ��ڻ�ѧ������֮�ȣ���v��CH
3OH��=v��CO��=0.08mol/��L?min����
�ʴ�Ϊ��80%��250�棻0.08��
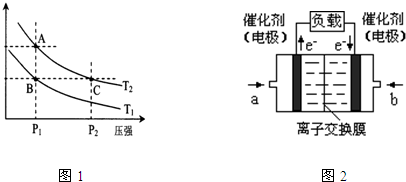
��3����ͼ��֪��C��ѹǿ��A��ѹǿ��ѹǿԽ��Ӧ����Խ�죬�ʷ�Ӧ����A��C��
��ͼ��֪A��C�����¶���ͬ��ƽ�ⳣ��ֻ���¶�Ӱ�죬�¶Ȳ���ƽ�ⳣ�����䣬��ƽ�ⳣ��A=C��
��ͼ��֪��ѹǿ��ͬʱ��ƽ����ϵ��H
2����������¶�T
1��T
2ʱ�ĵͣ�˵��T
1��T
2��ȣ�ƽ��������Ӧ�ƶ����÷�Ӧ����ӦΪ���ȷ�Ӧ�������¶�ƽ������ȷ�Ӧ�ƶ������¶�T
1��T
2����״̬B��״̬A���ɲ������µķ�����
�ʴ�Ϊ������=�����£�
��4��0.5mol�״�������ȫȼ�����ɶ�����̼�����Һ̬ˮ���ų�QKJ���������Ȼ�ѧ����ʽΪ2CH
3OH��g��+3O
2��g��=2CO
2��g��+4H
2O��l����H=-4Q kJ/mol��
��ͼ2�е��������·���ƶ���֪��aΪ������bΪ������ԭ��ظ�������������Ӧ��CH
3OH�ڸ����ŵ磬���������ŵ�����̼�����ˮ����ⷴӦʽΪCH
3OH-6e
-+8OH
-=CO
32-+6H
2O��
�ʴ�Ϊ��2CH
3OH��g��+3O
2��g��=2CO
2��g��+4H
2O��l����H=-4Q kJ/mol��CH
3OH-6e
-+8OH
-=CO
32-+6H
2O��



 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
 CH3OH��g����H
CH3OH��g����H