
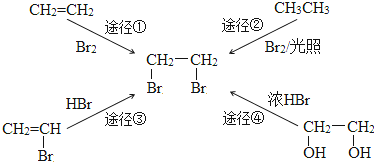
| A. | 途径① | B. | 途径② | C. | 途径③ | D. | 途径④ |
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
| A. | 反应在 前50s的平均速率v(PCl5)=0.0032mol.L-1.s-1 | |
| B. | 保持其它条件不变,升高温度,平衡时c(PCl5)=0.11mol.L-1,则该反应的△H<0 | |
| C. | 相同温度下,起始时向容器中充入1.0molPCl5、0.20molPCl3和0.20molCl2反应达到平衡前v正>v逆 | |
| D. | 相同温度下,起始时向容器中充入2.0molPCl3和2.0molCl2,达到平衡时,PCl3的转化率小于80% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素符号 | X | Y | Z | R | T |
| 原子半径(nm) | 0.160 | 0.186 | 0.102 | 0.143 | 0.074 |
| 主要化合价 | +2 | +1 | -2,+4,+6 | +3 | -2 |
| A. | 离子的还原性:T2->Z2- | |
| B. | 离子半径:T2->X2+ | |
| C. | 元素最高价氧化物对应水化物的碱性:Y>R>X | |
| D. | 形成氢化物的沸点:Z>T |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
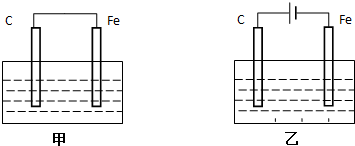
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石炭酸与NaOH溶液混合:H++OH-→H2O | |
| B. | 稀HNO3洗涤试管中的银镜:Ag+NO3-+2H+═Ag++NO↑+H2O | |
| C. | 乙烯使酸性KMnO4褪色:5C2H4+12MnO4-+36H+→12Mn2++10CO2↑+28H2O | |
| D. | 向CH2BrCOOH中加入足量的氢氧化钠溶液并加热: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
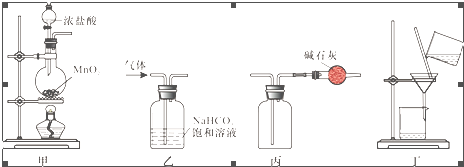
| A. | 用装置甲制取氯气 | |
| B. | 用装置乙除去氯气中的少量氯化氢 | |
| C. | 用装置丙收集氯气并防止污染空气 | |
| D. | 用装置丁分离二氧化锰和氯化锰溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 +2HNO3$→_{100-110℃}^{浓硫酸}$
+2HNO3$→_{100-110℃}^{浓硫酸}$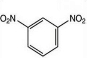 +2H2O.
+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 与NaOH水溶液共热,生成的有机物的结构简式为
与NaOH水溶液共热,生成的有机物的结构简式为 ;
; ;若该有机物有一个反式异构体,且能与氢气加成生成2-甲基戊烷,则该有机物的结构简式为
;若该有机物有一个反式异构体,且能与氢气加成生成2-甲基戊烷,则该有机物的结构简式为 ;
;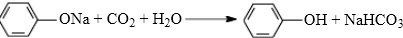 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com