

| A. | 等浓度的H2CO3、Na2CO3溶液中c(HCO3-)前者小 | |
| B. | 反应HCO3-+H2O?H2CO3+OH-的平衡常数为10-5.37 | |
| C. | 1L0.1mol•L-1NaHC2O4溶液和1L0.1mol•L-1的NaOH溶液混合,混合液中c(HC2O4-)+c(C2O42-)+c(H2C2O4)=0.1mol•L-1 | |
| D. | Na2CO3溶液中加入过量草酸溶液,发生反应:CO32-+H2C2O4═HCO3-+HC2O4- |
分析 A.等浓度的H2CO3、Na2CO3溶液中,碳酸分步电离,第二步电离出碳酸氢根离子,碳酸钠溶液中碳酸根离子水解生成碳酸氢根离子,所以c(HCO3-)前者小;
B、反应HCO3-+H2O?H2CO3+OH-的平衡常数为K=$\frac{c({H}_{2}C{O}_{3})c(O{H}^{-})}{c(HC{{O}_{3}}^{-})}$,据pH=6.37时计算;
C.1L0.1mol•L-1NaHC2O4溶液和1L0.1mol•L-1的NaOH溶液混合得到Na2C2O4溶液,溶液中存在物料守恒分析;
D.草酸的酸性比碳酸强,过量草酸和碳酸钠反应生成二氧化碳气体.
解答 解:A.等浓度的H2CO3、Na2CO3溶液中,碳酸分步电离,第二步电离出碳酸氢根离子,碳酸钠溶液中碳酸根离子水解生成碳酸氢根离子,所以c(HCO3-)前者小,故A正确;
B、反应HCO3-+H2O?H2CO3+OH-的平衡常数为K=$\frac{c({H}_{2}C{O}_{3})c(O{H}^{-})}{c(HC{{O}_{3}}^{-})}$,pH=6.37时,c(H2CO3)=c(HCO3-),K=c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-6.37}}$=10-7.63,根B错误;
C.1L0.1mol•L-1NaHC2O4溶液和1L0.1mol•L-1的NaOH溶液混合得到Na2C2O4溶液,溶液中存在物料守恒2c(HC2O4-)+2c(C2O42-)+2c(H2C2O4)=c(Na+)=0.1mol•L-1 ,故C错误;
D.Na2CO3溶液中加入过量草酸溶液发生反应生成二氧化碳气体:CO32-+2H2C2O4═CO2↑+H2O+2HC2O4-,故D错误;
故选A.
点评 本题考查了酸碱反应后溶液酸碱性和离子浓度大小比较、电离平衡常数计算、物料守恒等知识点的应用,掌握基础是解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | Ba(OH)2•8H2O与NH4Cl的反应 | B. | 乙烯与氧气的反应 | ||
| C. | 盐酸与NaOH溶液的反应 | D. | 铝粉与氧化铁粉末的铝热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 葡萄糖与果糖、淀粉和纤维素分别为同分异构体 | |
| B. | 若某有机物在氧气中充分燃烧生成CO2和H2O物质的量相等,则该有机物是乙烯 | |
| C. | 燃烧乙烷、环丙烷(C3H6)混合气体,所产生的CO2的量一定小于燃烧相同质量的丙烯所产生的CO2 | |
| D. | 相同质量的乙烯和乙醇在氧气中充分燃烧,消耗的氧气相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
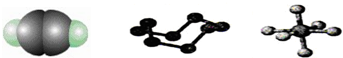
| A. | 32 g S8分子中含有0.125 mol σ键 | |
| B. | SF6是由极性键构成的非极性分子 | |
| C. | 1 mol C2H2分子中有3 mol σ键和2 mol π键 | |
| D. | 1 mol S8中含有8 mol S-S键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液的PH增大 | B. | 溶液中的Zn2+浓度增大 | ||
| C. | 溶液中的SO42- 浓度增大 | D. | 溶液的密度增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子化合物都是强电解质 | |
| B. | 水溶液能导电的物质都是电解质 | |
| C. | 强电解质溶液的导电性一定比弱电解质溶液的导电性强 | |
| D. | 浓度一定的强电解质溶液,升高温度时其导电性增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
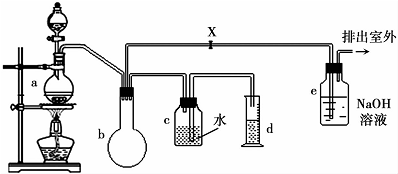
| 名称 | 熔点 | 沸点 | 溶解性 |
| 一氯甲烷 | -97.73℃ | -24.2℃ | 18℃时在水中微溶,与乙醚、丙酮或苯互溶,能溶于乙醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
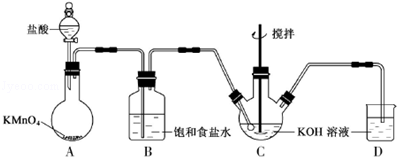
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在0.1 mol NaHSO4晶体中阳离子与阴离子总数为0.3NA | |
| B. | 25℃时,pH=13的1.0 LBa(OH)2溶液中含有的OH-数目为0.2NA | |
| C. | 常温常压下,4.4gCO2和N2O混合物中所含有的原子数为0.3 NA | |
| D. | 1L1 mol•L-1FeCl3完全水解生成NA个胶体粒子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com