
【题目】CH4和H2O在一定条件下, 可以转化为合成一系列有机化合物、氨的重要原料(CO+H2),这种方法称作甲烷水蒸气重整法制合成气,其能量变化如图:

(1)甲烷水蒸气重整法制合成气的热化学方程式为_______;该反应只有在_____(填“高温”、“低温”或“常温”)才自发进行。
(2)下列有关甲烷水然气重整法制合成气的说法正确的是_____(填字母)。
A.相同条件下,该反应的逆反应更易发生
B.恒温恒容时充入一定量CO2,可促进CH4转化并可调节CO和H2的比例
C.若反应的高效催化剂为A,则A一定是CO和H2合成CH4的高效催化剂
D.恒温时向上述平衡体系中充入少量Ar,平衡一定不移动
E.有副反应:H2O+CO![]() CO2+H2
CO2+H2
(3)在恒容密闭容器中充入2mol的CH4和H2O(g)混合气体,且CH4和H2O(g)的物质的量之比为x,相同温度下测得H2平衡产率与x的关系如图所示。请问a、b两点比较(填“>”、“<”、“=”);CH4的转化率a点____b点,a点CH4的浓度_____b点H2O(g)的浓度,氢气的产率a点_____b点。

(4)当充入CH4和H2O(g)物质的量之比1:2.2时,温度、压强p对平衡时CO体积分数φ(CO)的影响如图,则压强由大到小的排序是_____;当T<450℃和T≥1000℃时,压强p对φ(CO)几乎无影响的原因是_____________________。

(5)在下图左室充入1molCH4和H2O(g)混合气体(物质的量之比为1:1),恒温条件下反应建立平衡,测得CH4的转化率为50%,则其平衡常数为_________ 。

【答案】 CH4(g)+H2O(g)=CO(g)+3H2(g)ΔH=+206.1 kJ/mol 高温 ABCE > = = p3>p2>p1 当T<450℃时,几乎不反应,所以压强的改变对φ(CO) 几乎无影响;当T≥1000℃时,φ(CO)已经很大,甲烷的转化率已经达到了90%以上,所以压强的改变对φ(CO)影响很小。 0.75
【解析】(1)本题考查热化学反应方程式的书写,以及反应反应方向的进行,根据能量变化图,热反应方程式为CH4(g)+H2O(g)=CO(g)+3H2(g) △H=(240.1-34.0)kJ·mol-1=+206.1kJ·mol-1;根据△G=△H-T△S,此反应是吸热反应,即△H<0,此反应是熵增,即△S>0,因此能自发进行,△G<0,即在高温下;(2)本题考查影响化学反应速率的因素,A、根据图像,逆反应的活化能小,因此逆反应更易发生,故A正确;B、反应体系中存在CO+H2O ![]() CO2+H2反应,恒温恒容时充入一定量的CO2,可促进产物中H2反应,提高CH4的平衡转化率,并适当减少H2的物质的量,增加CO的物质的量,调节CO和H2的比例,故B正确;C、使用催化剂降低反应的活化能,某可逆反应的正反应使用催化剂一定也是逆反应的催化剂,故C正确;D、恒温恒容时充入非反应气体,组分的浓度不变,平衡不移动,如果是恒温恒压下,充入非反应气体,组分的浓度降低,平衡正向移动,故D错误;E、反应体系中存在CO+H2O
CO2+H2反应,恒温恒容时充入一定量的CO2,可促进产物中H2反应,提高CH4的平衡转化率,并适当减少H2的物质的量,增加CO的物质的量,调节CO和H2的比例,故B正确;C、使用催化剂降低反应的活化能,某可逆反应的正反应使用催化剂一定也是逆反应的催化剂,故C正确;D、恒温恒容时充入非反应气体,组分的浓度不变,平衡不移动,如果是恒温恒压下,充入非反应气体,组分的浓度降低,平衡正向移动,故D错误;E、反应体系中存在CO+H2O ![]() CO2+H2反应,故E正确;(3)本题是影响化学平衡移动的因素以及化学平衡的计算,x越大,甲烷的量越多,因此甲烷的转化率降低,即a点甲烷的转化率大于b点甲烷转化率;当比值为9:11,设甲烷为9mol,H2O为11mol, CH4(g)+H2O(g)=CO(g)+3H2(g)
CO2+H2反应,故E正确;(3)本题是影响化学平衡移动的因素以及化学平衡的计算,x越大,甲烷的量越多,因此甲烷的转化率降低,即a点甲烷的转化率大于b点甲烷转化率;当比值为9:11,设甲烷为9mol,H2O为11mol, CH4(g)+H2O(g)=CO(g)+3H2(g)
起始:9 11 0 0
变化:x x x 3x
平衡:9-x 11-x x 3x 氢气的体积分数为3x/(20+2x) 当比值为11:9,设甲烷为11mol,H2O为9mol,
CH4(g)+H2O(g)=CO(g)+3H2(g)
起始:11 9 0 0
变化:y y y 3y
平衡:11-y 9-y y 3y 氢气的体积分数为3y/(20+2y),因为在a点和b点,氢气的体积分数相等,即推出x=y,a点甲烷的浓度等于b点水蒸气的浓度;两点的氢气产率相等;(4)考查影响化学平衡移动的因素,相同温度下增大压强,平衡向逆反应方向移动,CO的体积分数减小,则压强p3>p2>p1;当T<450℃时,几乎不反应,所以压强的改变对φ(CO) 几乎无影响;当T≥1000℃时,φ(CO)已经很大,甲烷的转化率已经达到了90%以上,所以压强的改变对φ(CO)影响很小;(5)考查化学平衡常数的计算CH4(g)+H2O(g)=CO(g)+3H2(g)
起始:0.5 0.5 0 0
变化:0.25 0.25 0.25 0.75
平衡:0.25 0.25 0.25 0.75 等温等压下,体积之比等于物质的量之比,达到平衡后,容器的体积为1.5L,根据平衡常数的定义,K=c3(H2)×c(CO)/[C(CH4)×c(H2O)],代入数值,解得K=0.75。


科目:高中化学 来源: 题型:
【题目】在国际相对原子质量表上查得碳的相对原子质量是12.01,这里的12.01是指( )
A.碳元素的平均相对原子质量
B.碳原子质量
C.同位素C﹣12的行相原子质量
D.C﹣12的质量数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH3CH2CH=CH2是来自石油基本化工原料,现有如下转化关系:

己知:C为醛
(l)上述各步反应中所属反应类型分别为:______,______,______,______,______。
(2)A、B、C、D、G中官能团名称______,______,______,______,______。(官能团,是决定有机化合物的化学性质的原子或原子团。)
(3)B和D反应进行比较缓慢,请说出提高该反应速率的2种方法___________。
(4)写出属于醇但不能被O2催化氧化生成醛的B的所有同分异构体的结构简式________。
(5)写出除③外的各步反应的化学方程式:
① A→B:______________;
② B→C: ______________;
④ B+足量D→G: ______________;
⑤ G+ Na0H→B+E: ______________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~G是几种烃分子的球棍模型(如图),据此回答下列问题:

(1)常温下含氢量最高的烃是(填对应字母)________________;
(2)能够发生加成反应的烃有(填数字)________种;
(3)G与浓硝酸和浓硫酸的混酸共热生成的淡黄色晶体的名称(用系统命名法命名)__________;(不允许写简称)
(4)写出A失去一个氢原子形成的甲基的电子式______________________;
(5)写出F发生溴代反应的化学方程式:______________________
(6)写出实验室制取D的化学方程式__________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某探究小组用HNO3 与大理石反应过程中质量减小的方法研究影响反应速率的因素。所用HNO3浓度为1.00mol/L、2.00mol/L,大理石有细颗粒与粗颗粒两种规格,实验温度为298K、308K,每次实验HN03 的用量为25.0mL、大理石用量为10.00g。
(1)请完成以下实验设计表,在实验目的一栏中填出对应的实验编号:
试验编号 | T/K | 大理石规格 | HNO3浓度mol/L | 实验目的 |
① | 298 | 粗颗粒 | 2.00 | 实验①和②探究HNO3 浓度对该反应速率的影响; (II)实验①和____探究温度对该反应速率的影响; (III)实验①和____探究大理石规格(粗、细)对该反应速率的影响。 |
② | 298 | 粗颗粒 | 1.00 | |
③ | 308 | 粗颗粒 | 2.00 | |
④ | 298 | 细颗粒 | 2.00 |
(2)实验①中CO2质量随时间变化的关系见图:

依据反应方程式CaCO3+2HNO3=Ca(NO3)2+CO2↑+H2O,计算实验①在70~90s范围内HNO3的平均反应速率_______。(忽略溶液体积变化)
(3)请在上图中,画出实验②和③中CO2质量随时间变化关系的预期结果示意图,并标出线的序号_______。
(4)工业上己实现CO2和H2反应生成甲醇的转化。己知:在一恒温、恒容密闭容器中充入1mol CO2和3molH2,一定条件下发生反应:CO2(g)+3H2(g)=CH3OH(g)+H2O(g)。测得CO2和CH3OH (g)的浓度随时间变化如下图所示。请回答:
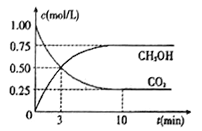
①达到平衡时H2的转化率为_______。在前10min内,用CO2表示的反应速率:V(CO2)=______mol/(L·min)
②能判断该反应达到化学平衡状态的依据是_______。
a.容器压强不变 b.混合气体中c(CO2)不变
c. v(CH3OH)=v(H2O) d. c(CH3OH)=c(H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列有关叙述正确的有( )
①标准状况下,20 g 重水(D2O)中含有的电子数为 10NA
②0.5 molFe2+被足量的 H2O2 溶液氧化,转移 0.5NA个电子
③将 2 mol NO 和 1 mol O2 混合后,体系中的分子总数为 3NA
④乙烯和环丙烷组成的 42 g 混合气体中氢原子的个数为 6NA
⑤2 molL﹣1 碳酸钠溶液中 Na+的数目是 2NA
⑥10LpH=1 的硫酸溶液中含有的 H+数为 2NA
⑦22.4 L 的 N2 的共用电子对数为 3NA
⑧将 0.1mol 氯化铁溶于 1L 水中,所得溶液含有 NA0.1个 Fe3+.
A.①④⑥ B.②③④ C.①②④ D.①②④⑧
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com