
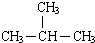 );
);分析 (1)有相同质子数,不同中子数的原子互为同位素;
(2)结构相似、分子组成相差若干个“CH2”原子团的有机化合物互相称为同系物;
(3)具有相同分子式而结构不同的化合物互为同分异构体.
解答 解:①${\;}_{1}^{1}$H、${\;}_{1}^{2}$H、${\;}_{1}^{3}$H均是氢元素的不同种原子,互为同位素;
②正丁烷(CH3CH2CH2 CH3)与异丁烷(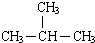 ),分子式相同,结构不同,属于同分异构体;
),分子式相同,结构不同,属于同分异构体;
③甲烷(CH4)与丙烷(C3H8),结构相似,分子组成相差若干个“CH2”原子团,属于同系物;
故答案为:(1)①;(2)③;(3)②.
点评 本题考查同位素、同素异形体、同分异构体、同系物的概念,掌握各自的概念是解决本题的关键,难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
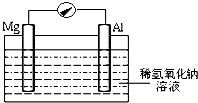 近年来,镁在汽车、航空、航天、机械制造、军事等产业中应用迅猛发展.
近年来,镁在汽车、航空、航天、机械制造、军事等产业中应用迅猛发展.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{94}^{238}$Pu的原子核内中子数为144 | |
| B. | ${\;}_{94}^{238}$Pu的原子核内质子数为94 | |
| C. | ${\;}_{94}^{238}$Pu的原子核外电子数为144 | |
| D. | ${\;}_{94}^{238}$Pu与${\;}_{94}^{239}$Pu的化学性质基本相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同一种核素 | B. | 互为同分异构体 | C. | 互为同素异形体 | D. | 互为同位素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D为前四周期元素.A元素的原子价电子排布为ns2np2,B元素的最外层电子数是其电子层数的3倍,C元素原子的M电子层的p亚层中有3个未成对电子,D元素原子核外的M层中只有2对成对电子.
A、B、C、D为前四周期元素.A元素的原子价电子排布为ns2np2,B元素的最外层电子数是其电子层数的3倍,C元素原子的M电子层的p亚层中有3个未成对电子,D元素原子核外的M层中只有2对成对电子.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D | |
| 强电解质 | HBr | FeCl3 | H2SO4 | Ca(OH)2 |
| 弱电解质 | HF | HCOOH | BaSO4 | HI |
| 非电解质 | NH3 | Cu | H2O | C2H5OH |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com