
 A、B、C、D为前四周期元素.A元素的原子价电子排布为ns2np2,B元素的最外层电子数是其电子层数的3倍,C元素原子的M电子层的p亚层中有3个未成对电子,D元素原子核外的M层中只有2对成对电子.
A、B、C、D为前四周期元素.A元素的原子价电子排布为ns2np2,B元素的最外层电子数是其电子层数的3倍,C元素原子的M电子层的p亚层中有3个未成对电子,D元素原子核外的M层中只有2对成对电子.分析 A、B、C、D均为前四周期元素.B元素的最外层电子数是其电子层数的3倍,B原子只能有2个电子层,最外层电子数为6,则B为O元素;C元素原子的M电子层的P亚层中有3个未成对电子,则其原子核外电子排布为1s22s22p63s23p3,故C为P元素;D元素原子核外的M层中只有2对成对电子,则其原子核外电子排布为1s22s22p63s23p4,故D为S元素.
(1)A元素的原子价电子排布为ns2np2,当n=2时,A是C元素,CO2为直线对称性结构,分子中正负电荷重心重合,结构式为O=C=O,双键含有1个σ键、1个π键;
(2)A元素的原子价电子排布为ns2np2,当n=3时,A是Si元素,硅和氧形成的晶体是二氧化硅晶体,属于原子晶体;
(3)若A元素的原子价电子排布为3s23p2,则A为Si,同周期随原子序数增大,元素第一电离能呈增大趋势,P元素原子3p能级容纳3个电子,为半满稳定状态,第一电离能高于同周期相邻元素;
(4)某红紫色络合物的组成为[Co(NH3)5(H2O)]Cl3.该络合物中的中心离子钴离子为+3价,结合能量最低原理书写Co3+的核外电子排布式,配位体之一的NH3分子的空间构型为三角锥形,Co3+与NH3之间形成配位键;
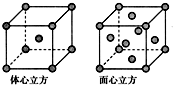
(5)体心立方晶胞中每个Fe原子周围有8个Fe原子,面心立方晶胞中,以顶点Fe原子为研究对象,与之最近的Fe原子处于面心,每个Fe原子周围有12个Fe原子.
解答 解:A、B、C、D均为前四周期元素.B元素的最外层电子数是其电子层数的3倍,B原子只能有2个电子层,最外层电子数为6,则B为O元素;C元素原子的M电子层的P亚层中有3个未成对电子,则其原子核外电子排布为1s22s22p63s23p3,故C为P元素;D元素原子核外的M层中只有2对成对电子,则其原子核外电子排布为1s22s22p63s23p4,故D为S元素.
(1)A元素的原子价电子排布为ns2np2,当n=2时,A是C元素,CO2为直线对称性结构,分子中正负电荷重心重合,属于非金属性分子,结构式为O=C=O,分子含有2个σ键、2个π键,
故答案为:非极性;2;2;
(2)A元素的原子价电子排布为ns2np2,当n=3时,A是Si元素,硅和氧形成的晶体是二氧化硅晶体,属于原子晶体,故答案为:原子;
(3)若A元素的原子价电子排布为3s23p2,则A为Si,同周期随原子序数增大,元素第一电离能呈增大趋势,P元素原子3p能级容纳3个电子,为半满稳定状态,第一电离能高于同周期相邻元素,故第一电离能:P>S>Si,
故答案为:P>S>Si;
(4)某红紫色络合物的组成为[Co(NH3)5(H2O)]Cl3.该络合物中的中心离子钴离子为+3价,Co3+的核外电子排布式为1s22s22p63s23p63d6,配位体之一的NH3分子的空间构型为三角锥形,Co3+与NH3之间形成配位键,
故答案为:1s22s22p63s23p63d6;三角锥形;配位键;
(5)体心立方晶胞中每个Fe原子周围有8个Fe原子,面心立方晶胞中,以顶点Fe原子为研究对象,与之最近的Fe原子处于面心,每个Fe原子周围有12个Fe原子,故体心立方晶胞和面心立方晶胞中Fe原子的配位数之比为8:12=2:3,
故答案为:2:3.
点评 本题考查物质结构与性质,涉及核外电子排布、分子结构与性质、化学键、电离能、晶胞计算等,侧重考查主干知识,需要学生具备扎实的基础知识,难度中等.


科目:高中化学 来源: 题型:解答题
 );
);查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol/L | B. | 0.5mol/L | C. | 0.25mol/L | D. | 0.2mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ①③ | C. | ②③ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水 | B. | NaOH溶液 | ||
| C. | 酚酞 | D. | 硝酸酸化的硝酸银溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | PM2.5含有的铅、镊、铬、钒、砷等对人体有害的元素均是金属元素 | |
| B. | 合成纤维和光导纤维都是有机高分子化合物 | |
| C. | 可以用SiN4、Al2O3,制作高温结构陶瓷制品 | |
| D. | 绿色化学的核心是应用化学原理对环境污染进行治理 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com