
【题目】下列方法中可以证明乙醇分子中羟基上的氢原子所处环境与其他氢原子明显不同的是( )
A.1mol乙醇完全燃烧生成3mol![]()
B.乙醇可以制饮料
C.1mol乙醇跟足量的![]() 作用得0.5mol
作用得0.5mol![]()
D.1mol 乙醇在催化剂作用下可与氧气反应生成1mol乙醛.
科目:高中化学 来源: 题型:
【题目】中学实验室常用如图所示装置制取少量溴苯,请回答下列问题。
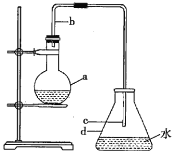
(1)烧瓶a中盛装的试剂是苯、液溴和铁屑。导管b的作用有两个:一是导气,二是起________的作用。
(2)反应过程中在导管c的下口附近可以观察到有白雾出现,这是由于反应生成的________(填化学式)遇水蒸气而形成的。
(3)反应完毕后,向锥形瓶d中滴入![]() 溶液,有________生成。
溶液,有________生成。
(4)反应完毕后,将烧瓶a中的液体倒入盛有冷水的烧杯中,可以观察到烧杯底部有棕色不溶于水的液体。这是溶解了溴的粗溴苯,可选用试剂________________除去溴。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氯(NOCl,熔点:-64.5 ℃,沸点:-5.5 ℃)是一种黄色气体,遇水易反应,生成一种氯化物和两种氧化物。可用于合成清洁剂、触媒剂及中间体等。实验室可由氯气与一氧化氮在常温常压下合成。
(1)甲组的同学拟制备原料气NO和Cl2,制备装置如下图所示:
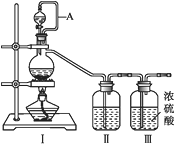
为制备纯净干燥的气体,下表中缺少的药品是:
装置Ⅰ | 装置Ⅱ | ||
烧瓶中 | 分液漏斗中 | ||
制备纯净Cl2 | MnO2 | ① | ② |
制备纯净NO | Cu | ③ | ④ |
②___________,③___________。
(2)乙组同学利用甲组制得的NO和Cl2制备NOCl,装置如图所示:

①装置连接顺序为a→___________________(按气流自左向右方向,用小写字母表示)。
②装置Ⅶ的作用为________________,若无该装置,Ⅸ中NOCl可能发生反应的化学方程式为_______________________________。
③乙组同学认为氢氧化钠溶液只能吸收氯气和NOCl,不能吸收NO,所以装置Ⅷ不能有效除去有毒气体。为解决这一问题,可将尾气与某种气体同时通入氢氧化钠溶液中,这种气体的化学式是__________。
(3)丙组同学查阅资料,查得王水是浓硝酸与浓盐酸的混酸,一定条件下混酸可生成亚硝酰氯和氯气,该反应的化学方程式为___________________。
(4)丁组同学用以下方法测定亚硝酰氯(NOCl)纯度
取Ⅸ中所得液体mg溶于水,配制成250mL溶液;取出25.00mL,以K2CrO4溶液为指示剂,用c mol/LAgNO3 标准溶液滴定至终点,消耗标准溶液的体积为b mL。(已知:Ag2CrO4为砖红色固体)
①亚硝酰氯(NOCl)的质量分数为_________(用代数式表示即可)。
②若滴定前,滴定管尖嘴有气泡,滴定后气泡消失,则所测亚硝酰氯的纯度_________(偏高、偏低、无影响)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以煤为原料可合成一系列燃料。
(1)已知:①2H2(g)+O2(g)=2H2O(g) ΔH=-483.6 kJ/mol,
②CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH=+49.0 kJ/mol
请写出甲醇燃烧生成H2O(g)的热化学方程式_________;
(2)向1 L密闭容器中加入2 mol CO、4 mol H2,在适当的催化剂作用下,发生反应:2CO(g)+4H2(g)CH3OCH3(l)+H2O(l) ΔH=+71 kJ/mol
①该反应能否_________自发进行(填“能”、“不能”或“无法判断”)
②下列叙述能说明此反应达到平衡状态的是_________.
a.混合气体的平均相对分子质量保持不变 b.CO和H2的转化率相等
c.CO和H2的体积分数保持不变 d.混合气体的密度保持不变
e.1 mol CO生成的同时有1 mol O-H键断裂
(3)CO2(g)+3H2(g)CH3OH(g)+H2O(g) ΔH<0在一定条件下,某反应过程中部分数据如下表:
反应条件 | 反应时间 | CO2(mol) | H2(mol) | CH3OH(mol) | H2O(mol) |
恒温恒容 (T1℃、2L) | 0min | 2 | 6 | 0 | 0 |
10min | 4.5 | ||||
20min | 1 | ||||
30min | 1 |
①0~10 min内,用H2O(g)表示的化学反应速率v(H2O)=_________mol/(L·min);
span>②达到平衡时,该反应的平衡常数K=_________(用分数表示),平衡时H2的转化率是_________;
③在其他条件不变的情况下,若30 min时向容器中再充入1 mol CO2(g)和1 mol H2O(g),则平衡_______移动(填“正向”、“逆向”或“不”);
(4)用甲醚(CH3OCH3)作为燃料电池的原料,请写出在碱性介质中电池负极反应式_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:4CO(g)+2NO2(g)4CO2(g)+N2(g) ΔH=-1200 kJ·mol1。在2 L恒容密闭容器中,按照下表中甲、乙两种方式进行投料,经过一段时间后达到平衡状态,测得甲中CO的转化率为50%。下列说法中正确的是
甲 | 乙 |
0.2 mol NO2 | 0.1 mol NO2 |
0.4 mol CO | 0.2 mol CO |
A.放热反应,一定能自发进行
B.该温度下,反应的平衡常数为5
C.达平衡时,NO2的浓度:甲>乙
D.达平衡时,N2的体积分数:甲<乙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法中不正确的是( )
A.某温度时的混合溶液中c(H+) =![]() mol·L-1,说明该溶液呈中性(Kw为该温度时水的离子积常数)
mol·L-1,说明该溶液呈中性(Kw为该温度时水的离子积常数)
B.常温下,由水电离出的c(H+)=10-12mol·L-1的溶液的pH可能为2或12
C.常温下,pH=3的CH3COOH与pH=11的NaOH溶液等体积混合后的溶液中:c(H+)>c(OH-)
D.常温下pH=7的CH3COOH和CH3COONa混合溶液中,c(Na+)=c(CH3COO-)+c(CH3COOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,隔板I固定不动,活塞Ⅱ可自由移动,M、N两个容器中均发生反应:A(g)+2B(g)![]() xC(g)△H=﹣192kJmol﹣1,向M、N中都通入1mol A和2mol B的混合气体,初始M、N容积相同,保持温度不变.下列说法正确的是( )
xC(g)△H=﹣192kJmol﹣1,向M、N中都通入1mol A和2mol B的混合气体,初始M、N容积相同,保持温度不变.下列说法正确的是( )

A. 若x=3,达到平衡后A的体积分数关系为:φ(M)>φ(N)
B. 若x>3,达到平衡后B的转化率关系为:α(M)>α(N)
C. 若x<3,C的平衡浓度关系为:c(M)>c(N)
D. x不论为何值,起始时向N容器中充入任意值的C,平衡后N容器中A的浓度均相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2)是一种黄绿色气体,易溶于水,在混合气体中的体积分数大于10%就可能发生爆炸,在工业上常用作水处理剂、漂白剂。回答下列问题:
(1)某小组设计了如下图所示的实验装置用于制备ClO2。
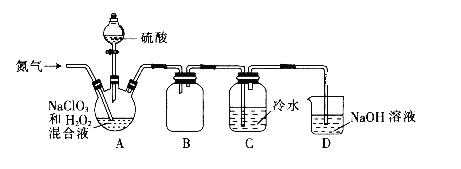
①通入氮气的主要作用有2个,一是可以起到搅拌作用,二是__________。
②装置B的作用是_________。
③当看到装置C中导管液面上升时应进行的操作是________。
(2)用0.1000mol·L-1的Na2S2O3标准液测定装置C中ClO2溶液的浓度。原理:2ClO2+10I-+8H+=5I2+2Cl-+4H2O , I2+2S2O32- = 2I- +S4O62-
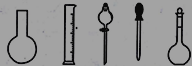
①配制0.1000molL-1的Na2S2O3标准溶液时所需仪器除在如图所示的仪器中进行选择外,还需用到的玻璃仪器是________(填仪器名称)
②在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度___0.1000molL-1(填“>”、“<”或“=”,下同);若Na2S2O3标准溶液在转移至容量瓶时,洒落了少许,则所得溶液浓度___0.1000molL-1。
③取10mLC中溶液于锥形瓶中,加入足量的KI溶液和H2SO4酸化,然后加入___________作指示剂,测得标准液消耗的体积为20.00mL,通过计算可知C中ClO2溶液的浓度为________ mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生想制作一种家用环保型消毒液发生器,用石墨作电极解饱和氯化钠溶液,通电时,为使Cl2被完成吸收投篮有较强杀菌能力的消毒液,设计了如图所示的装置,以下对电源电极名称和消毒液和主要成分判断正确的是( )
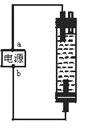
A.a为正极,b为负极:NaClO和NaCl
B.a为负极,b为正极:NaClO和NaCl
C.a为阳极,b为阴极:HClO和NaCl
D.a为阴极,b为阳极:HClO和NaCl
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com