
下图是部分短周期主族元素原子半径与原子序数的关系图,下列说法正确的是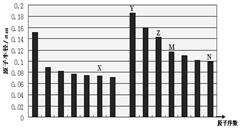
| A.非金属性:X>N |
| B.气态氢化物的稳定性:M<N |
| C.X和Y形成的化合物中只可能含离子键 |
| D.化合物MX2能与碱反应,不能与任何酸反应 |
AB
解析试题分析:图中14种元素分别位于第二、三周期第IA~VIIA族,由于同周期主族元素的原子半径随原子序数的增大而减小,同主族元素的原子半径随原子序数的增大而增大,则图中X、Y、Z、M、N分别为氧、钠、铝、硅、氯元素。X、N分别为氧、氯,由于氧无最高正价(+6),氯有最高正价(+7),说明氧的非金属性比氯的强,故A正确;M、N分别是硅、氯,由于硅的非金属性比氯弱,非金属性越弱,气态氢化物越稳定,则硅化氢的稳定性比氯化氢弱,故B正确;X、Y分别为氧、钠,二者形成的化合物分别为氧化钠、过氧化钠,Na2O只有离子键、Na2O2既有离子键又有共价键,故C错误;X、M分别为氧、硅,二者形成的二氧化硅是酸性氧化物,与碱能反应,氢氟酸是唯一能与二氧化硅反应的酸,故D错误。
考点:考查物质结构和元素周期律,涉及短周期主族元素原子半径、非金属性、气态氢化物的稳定性、氧化钠和过氧化钠的结构、二氧化硅的性质等。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:单选题
短周期主族元素X、Y、Z、W的原子序数依次增大,元素X的原子半径最小,Y 元素和X元素在一定条件下能形成YX,Z和W的原子序数相差8,W原子的电子总数是其电子层数的5倍。下列叙述正确的是
| A.Y可用于制造高性能可充电电池 |
| B.WX3的沸点高于ZX3 |
| C.Z的最高价含氧酸的酸性强于W的最高价含氧酸的酸性 |
| D.原子半径的大小顺序:rW>rZ>rY>rX |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
几种短周期元素的原子半径及主要化合价如下表:
| 元素代号 | X | Y | Z | W |
| 原子半径/pm | 160 | 143 | 70 | 66 |
| 主要化合价 | +2 | +3 | +5、+3、-3 | -2 |
| 元素化合物的性质 |  | 形成常见的两性氧化物 | Z2是常见保护气 | W3可用于杀菌消毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
短周期元素R、T、Q、W在元素周期表中的相对位置如下图所示,其中T所处的周期序数与族序数相等。下列判断不正确的是
| | | R | |
| T | Q | | W |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
短周期元素甲、乙、丙、丁、戊的原子序数依次增大,甲是周期表中原子半径最小的元素,乙形成的气态氢化物的水溶液呈碱性,乙与丁同族,丙、丁、戊同周期,丙单质可制成半导体材料,戊的最高化合价为+7,则
| A.原子半径:乙>丁>丙 |
| B.非金属性:丙>丁>戊 |
| C.甲与戊形成的化合物是共价化合物 |
| D.乙、丙、丁最高价氧化物对应的水化物均是强酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列叙述中,不能肯定金属A 比金属 B的活泼性强的是( )
| A.A能与热水反应产生H2,B 必须与水蒸气反应才产生H2 |
| B.A和B都是元素周期表的主族金属元素,A在 B的左下方 |
| C.1mol A能从酸中置换出1.5molH2,1mol B能从酸中置换出1molH2 |
| D.A和B都是元素周期表的主族金属元素,B的最高价氧化物的水化物不溶于水且具有两性,能被A的最高价氧化物的水化物溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下图是短周期元素原子半径与最外层电子数的关系图,其中乙单质是半导体,下列说法正确的是( )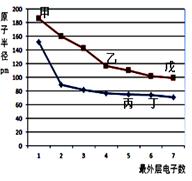
| A.丙的氢化物与丙的最高价氧化物的水化物能发生化合反应 |
| B.气态氢化物的稳定性:丙>丁>戊 |
| C.甲的离子半径比丁的简单离子半径小 |
| D.乙与丁形成的化合物含共价键,同时是两性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
原子序数依次增大的X、Y、Z、W四种短周期元素,X、W原子的最外层电子数与其电子层 数相等:Y能分别与X、Z形成原子个数比为1:3的化合物,常温下YX3是一种刺激性气味 的气体。下列说法正确的是
| A.原子半径:Z<Y<W,而离子半径:W<Y<Z |
| B.W的氯化物水溶液中滴加过量Z与钠形成的饱和溶液,可生成W配合物 |
| C.由X、Y、Z组成盐的水溶液呈酸性,则溶液中该盐阳离子浓度大于酸根离子浓度 |
| D.已知YX3沸点远高于YZ3,则Y—X键的键能高于Y—Z键 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
短周期元素的离子aW2+、bX+、cY2-、dZ-具有相同的电子层结构,下列推断正确的是( )
| A.原子半径:W>X>Z>Y | B.热稳定性:H2Y>HZ |
| C.离子半径:W2+>Y2- | D.碱性:XOH>W(OH)2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com