
【题目】已知由短周期元素构成的三种粒子:甲a(单核带一个单位正电荷)、乙I(四核不带电荷)、丙e(双核带一个单位负电荷),它们都有10个电子。物质A由甲、丙构成,B、C、D、K都是单质,反应①~⑤都是用于工业生产的反应,各有关物质之间的相互反应转化关系如下图所示:

请填写下列空白:
(1)写出下列物质的化学式:B________,I________,J________。
(2)A的化学式是__________________。
(3)写出下列反应的离子方程式:
①H+E(溶液)→M_________________________________________________________。
②I溶于G_______________________________________________________。
(4)写出反应④的化学方程式____________________________________________。
【答案】Cl2 NH3 NO NaOH H++ClO-===HClO NH3+H2O![]() NH3·H2O 2NaCl+2H2O
NH3·H2O 2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑
2NaOH+H2↑+Cl2↑
【解析】
a、I、e为三种由短周期元素构成的粒子,它们都有10个电子,a单核带一个单位的正电荷,应为Na+;I为四核分子,则I为NH3,e为双核的阴离子,则I为OH-;物质A由a、e构成,则A为NaOH,根据④电解生成A(NaOH),可考虑到氯碱工业,再结合反应①,可知B:Cl2;C:H2;H:HCl;又因H可以与E反应,则推知E:NaClO;F:NaCl;G:H2O;M:HClO;K:O2;再结合⑤即氨的催化氧化,可知D:N2;I:NH3;J:NO。
(1)由上述分析可以知道: B为Cl2,I为NH3,J为NO;
本题答案为:Cl2 、 NH3 、 NO。
(2)因为物质A由a、e构成,a是Na+、e是OH-,则A为NaOH,故A的化学式是NaOH;
本题答案为:NaOH。
(3)①有上述分析知, H是HCl、E是NaClO、M是HClO,所以H+E(溶液)→M的离子方程式为:H++ClO-===HClO;
本题答案为:H++ClO-===HClO。
②有上述分析知,I是NH3、G是H2O,故I溶于G的离子方程式为:NH3+H2O![]() NH3·H2O;
NH3·H2O;
本题答案为:NH3+H2O![]() NH3·H2O
NH3·H2O![]() NH4++OH-。
NH4++OH-。
(4)由分析知F为NaCl、G为H2O,所以反应④为电解食盐水的反应,故方程式为:2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑;
2NaOH+H2↑+Cl2↑;
本题答案为:2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑。
2NaOH+H2↑+Cl2↑。


科目:高中化学 来源: 题型:
【题目】日本产业技术综合研究所发布的锂空气电池的设计构思是负极采用金属锂条,中间设有用于隔开正极和负极的锂离子固体电解质,正极的水性电解液使用碱性水溶性凝胶,与由微细化碳和廉价氧化物催化剂形成的正极组合,既可以用作充电电池也可用作燃料电池使用,结构如图所示。下列有关该锂空气电池说法不正确的是( )
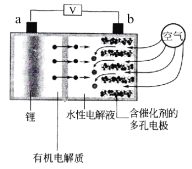
A.电池放电时,Li+穿过隔膜向b极移动得到LiOH溶液
B.放电时,外电路的电子由a经外电路流向b
C.充电时,a电极的电极反应为:Li+ + e- ═ Li
D.放电时,b极发生的电极反应为O2 - 4e- + 2H2O ═ 4OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)在200℃、101kPa时,0.5molH2(g)与足量I2(g)完全反应放出7.45kJ的热量,该反应的热化学方程式表示为____。
(2)根据键能数据估算
化学键 | C—H | C—F | H—F | F—F |
键能/(kJ·mol-1) | 414 | 489 | 565 | 155 |
CH4(g)+4F2(g) =CF4(g)+4HF(g)的反应热ΔH为______kJ/mol
(3) 已知:①2CH3OH(l)+3O2(g) =2CO2(g)+4H2O(g) ΔH1=-a kJ/mol
②C(s)+O2(g)=CO2(g) ΔH2=-b kJ/mol
③2H2(g) + O2(g) = 2H2O(g) ΔH3 = -c kJ/mol
a、b、c均大于0 则:反应①中,ΔS______(选填“>”、“<”或“=”)0;
2C(s)+4H2(g)+O2(g) = 2CH3OH(l) ΔH=_______kJ/mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组探究SO2气体的还原性,装置如图所示,下列说法不合理的是
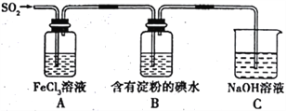
A. A装置中FeCl3溶液逐渐变为浅绿色,可以说明SO2有还原性
B. B装置中蓝色退去,说明还原性:SO2>I-
C. C装置中吸收尾气有可能倒吸
D. A、B装置中发生的反应转移电子数一定相等。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某离子反应中涉及![]() 六种微粒,其中
六种微粒,其中![]() 的物质的量随时间变化的曲线如图所示。下列判断正确的是( )
的物质的量随时间变化的曲线如图所示。下列判断正确的是( )
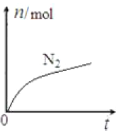
A.该反应的氧化剂是![]() ,还原产物是
,还原产物是![]() B.消耗
B.消耗![]() 还原剂,转移
还原剂,转移![]() 电子
电子
C.氧化剂与还原剂的物质的量之比为![]() D.水是生成物,且反应后溶液的酸性明显增强
D.水是生成物,且反应后溶液的酸性明显增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向100mL Fe2(SO4)3和CuSO4的混合溶液中逐渐加入铁粉,充分反应后溶液中固体剩余物的质量与加入铁粉的质量如图所示。忽略溶液体积的变化,下列说法正确的是( )

A.a点时溶液中阳离子仅为Cu2+和Fe2+
B.b点时溶液中发生的反应为:Fe+Cu2+=Cu+Fe2+
C.c点时加入的铁粉与Cu2+反应
D.原溶液中Fe2(SO4)3和CuSO4的物质的量浓度之比为1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一块非常独特的手表,用 H~Mg 12 种元素分别表示 1:00~12:00,关于此表的下列说法中不正确的是( )
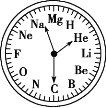
A.2:00 时的时针和 12:00 时的分针所指元素极难形成化合物
B.7:00 时,时针和分针所指元素可能形成相对分子质量为 100 的化合物
C.8:00 时,时针和分针所指元素形成的化合物属于碱性氧化物
D.3:00 时,时针所指元素的金属性比 11:00 时时针所指元素的金属性强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】双氧水是一种重要的绿色试剂,工业上可采取电解较稀浓度的硫酸来制取双氧水(H2O2为还原产物),其电解的化学方程式为:3H2O+3O2![]() O3+3H2O2。下列有关说法正确的是
O3+3H2O2。下列有关说法正确的是
A. 电解池的阳极生成双氧水,阴极生成臭氧
B. 电解池中H+移向阴极
C. 产生臭氧的电极反应式为3H2O+6e-=O3+6H+
D. 产生双氧水的电极反应式为2H2O-2e- =H2O2+2H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锶(Sr)为第5周期ⅡA族元素。高纯六水氯化锶晶体(SrCl2.6H2O)具有很高的经济价值,61℃时晶体开始失去结晶水,100℃时失去全部结晶水。用工业碳酸锶粉末(含少量Ba、Fe的化合物等杂质)制备高纯六水氯化锶晶体的过程如下图所示。

请回答:
(1)常温下,氯化锶溶液pH____7(填“大于”、“等于”或“小于”);
(2)步骤③所得滤渣的主要成分是______(填化学式),调节溶液pH至8~10,宜选用的试剂为 ______。
A.稀硫酸 B.氢氧化锶粉末 C.氢氧化钠 D.氧化锶粉末
(3)步骤⑤中,洗涤氯化锶晶体最好选用____。
A.水 B.稀硫酸 C.氢氧化钠溶液 D.氯化锶饱和溶液
(4)工业上用热风吹干六水氯化锶,选择的适宜温度范围是____(填字母)。
A.50~60℃ B.70~80℃ C.80~100℃ D.100℃以上
(5)若滤液中Ba2+浓度为1×10-6 mol/L,依据下表数据可以推算滤液中Sr2+物质的量浓度为 ________。
 .
.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com