
【题目】浓H2SO4 密度1.84g/mL,物质的量浓度为18.4mol/L,质量分数为98%,取10mL浓H2SO4和a mL水混合得物质的量浓度为C mol/L,质量分数为b%.下列组合正确的是( )
(1)若C=9.2则a>10 b>49%
(2)若C=9.2则a>10 b<49%
(3)若b=49则a=18.4 C<9.2
(4)若b=49则a=18.4 C>9.2.
A.(1)(3) B.(1)(4) C.(2)(3) D.(2)(4)
【答案】A
【解析】
试题分析:若C=9.2,根据稀释定律计算稀释后溶液的体积,硫酸的浓度越大,密度越大,确定混合后溶液的质量与10mL原浓硫酸质量关系,进而确定稀释后溶液质量分数;根据稀释过程中溶质硫酸的质量不变列方程计算a;
若b=49,根据稀释过程中溶质硫酸的质量不变列方程计算a,结合c=![]() mol/L计算49%的硫酸的浓度,据此计算判断.
mol/L计算49%的硫酸的浓度,据此计算判断.
解:若C=9.2,根据稀释定律,可知稀释后溶液的体积为10mL×![]() =20mL,硫酸的浓度越大,密度越大,故稀释后溶液的质量小于原浓硫酸质量的2倍,稀释过程硫酸的质量不变,故稀释后硫酸的质量分数大于49%,稀释过程中溶质硫酸的质量不变,则:10mL×1.84g/mL×98g%<(10mL×1.84g/mL+amL×1g/mL)×49%,解得a>18.4;
=20mL,硫酸的浓度越大,密度越大,故稀释后溶液的质量小于原浓硫酸质量的2倍,稀释过程硫酸的质量不变,故稀释后硫酸的质量分数大于49%,稀释过程中溶质硫酸的质量不变,则:10mL×1.84g/mL×98g%<(10mL×1.84g/mL+amL×1g/mL)×49%,解得a>18.4;
若b=49,稀释过程中溶质硫酸的质量不变,则:10mL×1.84g/mL×98g%=(10mL×1.84g/mL+amL×1g/mL)×49%,解得a=18.4,令稀释后的密度为dg/mL,则d<1.84,稀硫酸的物质的量浓度C=![]() mol/L<9.2mol/L,
mol/L<9.2mol/L,
故选A.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】对于溶液中的反应:MnO+5Fe2++8H+===5Fe3++Mn2++4H2O,下列措施能使化学反应速率提高的是( )
A.加水
B.增加同浓度FeSO4的用量
C.向溶液中滴加稀硫酸
D.加入少量KMnO4晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关一些工业生产原料的叙述中,错误的是( )
A.制普通玻璃的主要原料是纯碱、石灰石、石英
B.变色玻璃是在普通玻璃中加入适量的溴化银和氧化铜的微小晶粒
C.氮化硅高温结构陶瓷可由硅和氮气在常温反应制得
D.制造普通水泥的主要原料是粘土、石灰石
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表是学习化学的重要工具,它隐含着许多信息和规律.下表所列是五种短周期的原子半径及主要化合价(已知铍的原子半径为0.089nm)
元素代号 | A | B | C | D | E |
原子半径/nm | 0.16 | 0.143 | 0.102 | 0.099 | 0.074 |
主要化合价 | +2 | +3 | +6、﹣2 | ﹣1 | ﹣2 |
(1)A和E两元素组成的化合物的电子式 .
(2)B的最高价氧化物的水化物与C的最高价氧化物的水化物反应的离子方程式为:
(3)上述五种元素的最高价氧化物对应水化物的酸性最强的是 (填化学式)
(4)C和E形成的化合物中具有还原性的是 (填化学式).
(5)A和D所形成化合物的晶体类型: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组采用HgSO4作催化剂,使乙炔水化为乙醛(在75℃左右)。但HgSO4遇到某些特定物质常会发生催化剂中毒而失去催化作用,H2S就是其中一种。现选用块状电石、浓硫酸、水、NaOH溶液、HgO粉末五种物质制乙醛,装置图如下所示,回答下列问题:
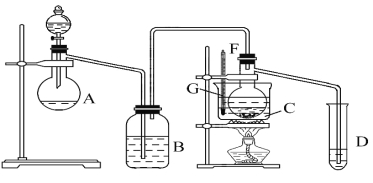
(1)实验开始时,仪器A中盛放电石,B中应装入________,其作用是___________。
(2)仪器D中盛放水,其作用是_________。
(3)蒸馏烧瓶F中应加入HgO和另外两种试剂,若将三者分别直接加入,请按加入的先后顺序写出包括HgO在内的各种试剂的名称__________。
(4)所选用温度计G的量程表示正确的是________。
A.0~50℃ B.0~100℃
C.0~200℃ D.50~100℃
(5)检验乙醛已制出的操作、现象是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原电池是化学对人类的一项重大贡献.某兴趣小组为研究原电池原理,设计如图装置.
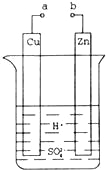
(1)a和b不连接时,烧杯中发生反应的离子方程式是
(2)a和b用导线连接,Cu极为原电池 极(填“正”或“负”),电极反应式是;Zn极发生 (填“氧化”或“还原”)反应,溶液中H+移向 (填“Cu”或“Zn”)极.
(3)a和b用导线连接,若Zn片质量减轻了6.5g,则另一极上理论上产生气体 L(标况下).
(4)有同学向把Ba(OH)28H2O晶体与NH4Cl晶体的反应设计成原电池,你认为是否可行? (填“是”或“否”),理由是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子中能大量共存的是( )
A.K + 、SiO32-、OH - 、Na +
B.Na + 、H + 、CO32-、SO42-
C.K + 、H + 、SiO32-、Cl -
D.OH - 、Na + 、HCO3-、Cl –
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com