
����Ŀ��Ԫ�����ڱ���ѧϰ��ѧ����Ҫ���ߣ���������������Ϣ���ɣ��±����������ֶ����ڵ�ԭ�Ӱ뾶����Ҫ���ϼۣ���֪���ԭ�Ӱ뾶Ϊ0.089nm��
Ԫ�ش��� | A | B | C | D | E |
ԭ�Ӱ뾶/nm | 0.16 | 0.143 | 0.102 | 0.099 | 0.074 |
��Ҫ���ϼ� | +2 | +3 | +6����2 | ��1 | ��2 |
��1��A��E��Ԫ����ɵĻ�����ĵ���ʽ ��
��2��B������������ˮ������C������������ˮ���ﷴӦ�����ӷ���ʽΪ��
��3����������Ԫ�ص�����������Ӧˮ�����������ǿ���� ���ѧʽ��
��4��C��E�γɵĻ������о��л�ԭ�Ե��� ���ѧʽ����
��5��A��D���γɻ�����ľ������ͣ� ��
���𰸡���1��![]() ��
��
��2��Al��OH��3+3H+=Al3+3H2O��
��3��HClO4��
��4��SO2��
��5�����Ӿ��壮
�����������������������Ԫ���У�C��E������2�ۣ�������A�壬C��+6����ԭ�Ӱ뾶C��E����CΪ��EΪ����D����1�ۣ�ԭ�Ӱ뾶����������DΪCl��A��B���ϼ۷ֱ�Ϊ+2��+3���ֱ�����A�塢��A�壬ԭ�Ӱ뾶A��B����AΪMg��BΪAl���ݴ˽��
�⣺������Ԫ���У�C��E������2�ۣ�������A�壬C��+6����ԭ�Ӱ뾶C��E����CΪ��EΪ����D����1�ۣ�ԭ�Ӱ뾶����������DΪCl��A��B���ϼ۷ֱ�Ϊ+2��+3���ֱ�����A�塢��A�壬ԭ�Ӱ뾶A��B����AΪMg��BΪAl��
��1��A��E��Ԫ����ɵĻ�����ΪMgO������ʽΪ��![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��
��2��B������������ˮ����ΪAl��OH��3��C������������ˮ����ΪH2SO4�����߷�Ӧ�����ӷ���ʽΪ��Al��OH��3+3H+=Al3+3H2O���ʴ�Ϊ��Al��OH��3+3H+=Al3+3H2O��
��3����������Ԫ����Cl�ķǽ�������ǿ��������������Ӧˮ�����������ǿ���� HClO4���ʴ�Ϊ��HClO4��
��4��C��E�γɵĻ������о��л�ԭ�Ե���SO2���ʴ�Ϊ��SO2��
��5��A��D���γɻ�����ΪMgCl2���������Ӿ��壬�ʴ�Ϊ�����Ӿ��壮



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʵ����ص�������ȷ����
A. ϡ��Ũ����ʱ��Ӧ������ˮ�ز���������ע��Ũ������
B. ������Һʱ������ˮ��������ƿ�̶ȣ�Ӧ�ý�ͷ�ιܽ�������Һ����
C. ʢ��NaOH��Һʱ��ʹ�ô�����ƿ����ĥ��ƿ
D. ����ij��Һ�Ƿ���SO42-ʱ��Ӧȡ��������Һ�����μ���ϡ�����BaCl2��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ı��⡿�����߽���ѧʵ����ʱ������Ҫ�����Ķ������ء�ʵ���Ұ�ȫ������������ʵ�����е�ѧ����Ϊ������ʵ���Ұ�ȫ�淶���ǣ��ش��������ɣ���

(1)_____________________________________________________
(2)_____________________________________________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������У�������ͨ����˵������ϳɲ��ϵ����� ��
A������ B�������� C���ϳ���ά D���ϳ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ȼ��������Ȼ����ˮ������γɵľ������ʣ���Ҫ�����ڶ�����ͺ��״�½���С��ݲⶨÿ0.1m3���塰��ȼ�������ͷų�20m3�������壬������˵���в���ȷ���ǣ� ��
A������ȼ�����ͷŵļ���������
B������ȼ�����ķֽ����ͷţ��������շ��������ֺ�����������ЧӦ
C������ȼ��������Ϊ����ĺ�����Դ
D������ȼ������ˮ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ŨH2SO4 �ܶ�1.84g/mL�����ʵ���Ũ��Ϊ18.4mol/L����������Ϊ98%��ȡ10mLŨH2SO4��a mLˮ��ϵ����ʵ���Ũ��ΪC mol/L����������Ϊb%�����������ȷ���ǣ� ��
��1����C=9.2��a��10 b��49%
��2����C=9.2��a��10 b��49%
��3����b=49��a=18.4 C��9.2
��4����b=49��a=18.4 C��9.2��
A����1����3�� B����1����4�� C����2����3�� D����2����4��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ�Ƶõĵ�������AlN����Ʒ�г���������Al4C3��Al2O3��C�����ʣ�ijͬѧ���������ʵ��ֱ�ⶨ��������AlN����Ʒ��AlN��Al4C3����������������NH3��ǿ������Һ�е��ܽ⣩��
��1��ʵ��ԭ������Al4C3�����ᷴӦ������CH4����AlN����ǿ�������Σ�����ǿ�����ɰ�����д��Al4C3�����ᷴӦ�Ļ�ѧ���� ��
��2��ʵ��װ�ã���ͼ��ʾ����

��3��ʵ����̣�
������ʵ��װ�ã�����װ�õ������ԣ��Ƶ�Dװ�õ�����Ϊyg���ζ��ܵĶ���ΪamL��
�ڳ�ȡxgAlN��Ʒ����װ��Bƿ�У����ý������رջ���K2��K3������K1��ͨ����Һ©������ϡ���ᣬ��װ��Bƿ�����ʳ�ַ�Ӧ��
�۴���Ӧ������ȫ�رջ���K1������K3��ͨ����Һ©���������NaOH����װ��Bƿ�����ʳ�ַ�Ӧ��
�� ������ò�Ӧ���еIJ�������
�ݼ�¼�ζ��ܵĶ���ΪbmL���Ƶ�Dװ�õ�����Ϊzg��
��4�����ݷ���������֪����ʵ�������µ�����Ħ�����ΪVm Lmol��1��
��Al4C3����������Ϊ ��
������ȡ�ζ�������������ʱ��Һ������ҵͣ��������������� ���ƫ����ƫС������Ӱ�족��ͬ��������Һ©��������ƿ��û��������ͨ���������������� ��
��AlN����������Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͭ���ǹ�ҵ��ͭ����Ҫԭ�ϣ�����Ҫ�ɷ�ΪCuFeS2������һ����Ȼ��ͭ��(��SiO2)��Ϊ�˲ⶨ�û�ͭ��Ĵ��ȣ���ͬѧ�������ͼ1ʵ�飺
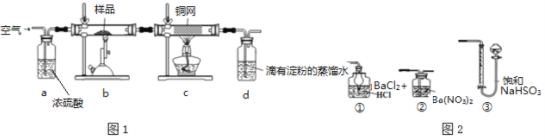
�ֳ�ȡ��ϸ�Ļ�ͭ����Ʒ1.84g���ڿ��������½������գ�����Cu��Fe3O4��SO2���壬ʵ���ȡd����Һ��![]() ������ƿ�У���0.05mol/L������Һ���еζ������ı���Һ20mL����ش��������⣺
������ƿ�У���0.05mol/L������Һ���еζ������ı���Һ20mL����ش��������⣺
(1)����Ʒ��ϸ���ٷ�Ӧ����Ŀ���� ��
(2)װ��a��c�����÷ֱ���_ �� (���ţ����Զ�ѡ)��
a����ȥSO2����
b����ȥ�����е�ˮ����
c��������������
d�������ڹ۲��������
e����ȥ��Ӧ����������
(3)�ζ����յ�ʱ�������� ��
(4)������Ӧ����������ͨһ��ʱ��Ŀ�������Ŀ���� ��
(5)ͨ�������֪���û�ͭ��Ĵ���Ϊ ��
��ͬѧ�ڼ�ͬѧʵ��Ļ����ϣ������������ײ�ͬ�����շ������������ղ�������йش�����ͬ��Ҳ����˻�ͭ��Ĵ��ȡ�
(6)����һ������ͼ2װ���������ʵ��װ��d��ͬ�����Դﵽʵ��Ŀ���� (�����)��
(7)����������ԭװ��d�е���Һ��ΪBa(OH)2������õĻ�ͭ��ȴ������+1%��������ʵ����������ȷ�����ܵ�ԭ����Ҫ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������������ʣ����ƾ�����ͭ���������������������������ǡ� �������ᡢ��̼�����ơ������ᡢ�����⡢��Al2��SO4��3���������ʵ������д���пհ�
��1������ǿ����ʵ��У� ��
��2��Һ̬ʱ�ܵ�����Ϊ�����仯���У� ��
��3������ˮ��Һ�ĵ��뷽��ʽΪ ��
����A��B��C��D��Ϊ��ѧ��ѧ�����Ĵ����A�ǵ��ʡ�����֮�������µķ�Ӧ��ϵ��
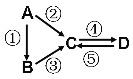
��1����A�ǵ���ɫ���壬C��D���������C������������Ҫ���ʡ�����C���ʿɵõ��м�ֵ�Ļ�ѧƷ��д���û�ѧƷ����1�����1���ε����� �� ��
��2����B����̬�⻯����C��D���������һ���ɹ⻯ѧ������Ⱦ��B��C��һ�������·�Ӧ���ɵ�A�Ǵ�����Ҫ�ɷ֣�д���÷�Ӧ�Ļ�ѧ����ʽ ��
��3����D���ʾ������ԣ��ڢ���Ӧ��Ҫ��ǿ����Һ������Ӧ��ͨ��������һ����������ЧӦ����Ҫ�������жϵ���A��Ԫ�������ڱ��е�λ����___ _____��д����Ӧ���ӷ��� ��
��4����A��Ӧ����㷺�Ľ���������Ӧ�õ�A���ڢ���Ӧ���õ�ͬһ�ַǽ������ʡ�C����Һ����ʴ��ӡˢͭ��·�壬д�÷�Ӧ�����ӷ���ʽ ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com