
【题目】往含Cl-和I-的稀溶液中滴入AgNO3溶液,沉淀的质量与加入AgNO3溶液体积的关系如图所示。下列说法正确的是
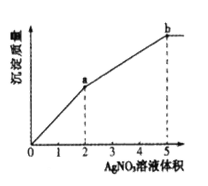
A.KSP (AgCl) < KSP (AgI)
B.c( Cl- ) :c( I-) =3:2
C.m( AgCl ) :m( AgI ) =" 2" :3
D.a~b段产生黄色沉淀
【答案】B
【解析】
氯化银相对分子质量小于碘化银,依据图象0-a、a-b段斜率可知,0-a生成的为碘化银,a-b段生成为氯化银,依据根据发生反应:I-+Ag+=AgI↓,Cl-+Ag+=AgCl↓判断原溶液中n(I-)、n(Cl-),依据消耗的硝酸银的体积判断生成m(AgCl):m(AgI),据此解答。
氯化银相对分子质量小于碘化银,依据图象0-a、a-b段斜率可知,0-a生成的为碘化银,a-b段生成为氯化银,
A.依据溶度积规则,可知向含Cl-和I-的稀溶液中滴入AgNO3溶液,先产生碘化银,说明碘化银溶解度小于氯化银,所以KSP(AgCl)>KSP(AgI),故A错误;
B.从图象可知,反应碘离子消耗硝酸银2体积,反应氯离子消耗硝酸银3体积,依据方程式:I-+Ag+=AgI↓,Cl-+Ag+=AgCl↓可知n(I-):n(Cl-),而氯离子、碘离子在同一溶液中,所以c(Cl-):c(I-)=3:2,故B正确;
C.从图象可知,反应碘离子消耗硝酸银2体积,反应氯离子消耗硝酸银3体积,依据方程式:I-+Ag+=AgI↓,Cl-+Ag+=AgCl↓可知n(I-):n(Cl-),所以生成碘化银和氯化银的物质的量之比为:n(AgCl):n(AgI)=3:2,m(AgCl):m(AgI)=3×143.5:2×162.5≠2:3,故C错误;
D.往含Cl-和I-的稀溶液中滴入AgNO3溶液,先发生I-+Ag+=AgI↓,0-a段,生成的碘化银为黄色沉淀,故D错误;
故选:B。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中能大量共存的是( )
A.无色透明的溶液中: Fe3+、Mg2+、SCN 、Cl
B.![]() =1×10-12的溶液中:K+、Na+、CO32、NO3
=1×10-12的溶液中:K+、Na+、CO32、NO3
C.![]() 的溶液中: K+、NH4+、MnO4、SO42-
的溶液中: K+、NH4+、MnO4、SO42-
D.能使甲基橙变红的溶液中: Na+、NH4+、SO42-、HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z、W为短周期元素,X的一种核素的质子数为8;Y和Ne原子的核外电子数相差1;Z的单质是一种常见的半导体材料;W的非金属性在同周期元素中最强。其原子半径随原子序数变化如图所示。
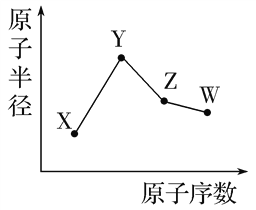
下列说法正确的是
A.对应简单离子半径:W>Y>X
B.对应气态氢化物的稳定性:Z>W
C.化合物YWX中既含离子键,又含共价键
D.Z的氧化物能与W的气态氢化物、Y的最高价氧化物对应水化物的溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与应叙述相符的是
A.图1表示向![]() 氯水中逐滴加入
氯水中逐滴加入![]() 醋酸,溶液导电性随加入酸体积的变化
醋酸,溶液导电性随加入酸体积的变化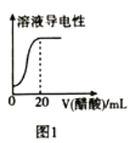
B.图2表示酸性介质![]() 原电池反应过程中的电流强度的变化,T时可能加入了
原电池反应过程中的电流强度的变化,T时可能加入了![]()
C.图3表示SO2与![]() 反应过程中的能量变化,其中
反应过程中的能量变化,其中![]()

D.图4表示在饱和![]() 溶液中逐步加
溶液中逐步加![]() 固体后,溶液中
固体后,溶液中![]()
![]() 的浓度变化
的浓度变化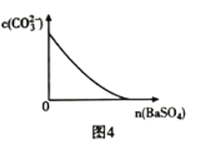
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应 A2+B2 = 2AB 的能量变化如图所示,则下列说法正确的是( )

A.该反应是吸热反应
B.断裂1molA-A键和1molB-B键能放出x kJ 的能量
C.2molAB的总能量高1mol A2和1molB2和的总能量
D.断裂2molA-B键需要吸收y kJ的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知锌及其化合物的性质与铝及其化合物相似。如图横坐标为溶液的pH,纵坐标为Zn2+或[Zn(OH)4 ]2-的物质的量浓度的对数。25℃时,下列说法中不正确的是

A. 往ZnCl2溶液中加入过量氢氧化钠溶液,反应的离子方程式为Zn2++4OH-=[Zn(OH)4]2-
B. 若要从某废液中完全沉淀Zn2+,通常可以调控该溶液的pH在8.0—12.0之间
C. pH=8.0与pH=12.0的两种废液中,Zn2+浓度之比为108
D. 该温度时,Zn(OH)2的溶度积常数(Ksp)为1×l0-10
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示装置的叙述,正确的是( )
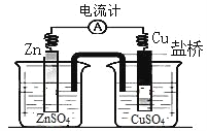
A.铜做正极,铜片上有气泡产生
B.盐桥中的阴离子会移向 CuSO4 溶液
C.正极附近的 SO![]() 浓度逐渐增大
浓度逐渐增大
D.锌片表面被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列溶液中各微粒浓度关系正确的是( )
A.向氨水中滴加稀硫酸至溶液呈中性:c(NH4+)=c(SO![]() )>c(OH-)=c(H+)
)>c(OH-)=c(H+)
B.向 l00mL 3 mol/L 的 NaOH 溶液中通入标准状况下体积为 4.48L 的 CO2:3c(Na+)=2[c(CO3 2-)+c(HCO3-)+c(H2CO3)]
C.CH3COONa 溶液中加入少量 KNO3 后溶液一定有:c(Na+)+c(H+)=(CH3COO 一)+c(OH 一)
D.等物质的量浓度的①NH4HSO4、②NH4HCO3、③NH4Cl 溶液中,c(NH4+)的大小关系:①>②>③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com