
【题目】化学与社会、生产和生活密切相关。下列说法错误的是
A.科学家在室温下将气态二氧化碳转化为固体碳材料,该变化是化学变化
B.中国天眼用到碳化硅,芯片用到高纯硅,石英玻璃用到硅酸盐
C.“辽宁舰”上用于舰载机降落拦阻索的特种钢缆,属于新型无机金属材料
D.看电影时,我们可以看到放映机投射的光柱,这是气溶胶发生的丁达尔现象
 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案科目:高中化学 来源: 题型:
【题目】(1)相邻的两个或多个原子之间 ,叫作化学键。通常,主族元素中活泼的 和活泼的 相互化合时分别失去和得到电子,形成具有稀有气体元素原子结构的 离子和 离子。这些离子之间除了有相互吸引的作用外,还有 和 、 和 之间的相互排斥作用。当两种离子之间接近到一定距离时, 和 作用达到了平衡,于是就形成了稳定的化学键。这种由 间通过 所形成的化学键叫作离子键。
(2)写出下列物质的电子式:
①氟化钙 ;
②溴化钾 ;
③硫化钠 ;
④氧化钙 。
(3)用电子式表示下列离子化合物的形成过程:
①氧化钠 。
②氯化镁 。
③硫化钠 。
④氯化铷 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(双选)如图为元素周期表中短周期的一部分,四种元素均为非稀有气体元素。下列关于这四种元素及其化合物的说法中正确的是( )
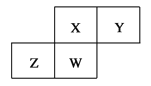
A.Y元素的非金属性是表中所列元素中最强的
B.X的最高正价可能为+6价
C.W的最高正化合价与最低负化合价的绝对值可能相等
D.Z的最高价氧化物的水化物可能为强碱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室常用锌与稀硫酸反应制取H2 . 欲使产生H2的速率加快,下列措施可行的是( )
A.加水稀释
B.加少量NaOH溶液
C.降低温度
D.锌片改为锌粉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、T、V为5种短周期元素,X、Y、Z在周期表中位置如图所示。这3种元素原子序数之和是41,X和T在不同条件下反应,可以生成T2X(白色固体)和T2X2(淡黄色固体)两种化合物。V单质在Z单质中燃烧产生苍白色火焰,产物溶于水能使紫色石蕊溶液变红,则:
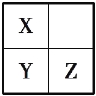
(1)5种元素的元素符号分别是X_______,Y_______,Z ,T ,V 。
(2)Y的原子结构示意图是__________________。
(3)T、X形成化合物T2X与T2X2的化学方程式分别为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇可作为燃料电池的原料。工业上利用CO2和H2在一定条件下反应合成甲醇。
(1)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH=-1275.6 kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g) ΔH=-566.0 kJ/mol
③ H2O(g) = H2O(l) ΔH=-44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式: 。
(2)甲醇脱氢可制取甲醛CH3OH(g)![]() HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如下图所示。回答下列问题:
HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如下图所示。回答下列问题:

①600K时,Y点甲醇的υ(逆) (正)(填“>”或“<”)
②从Y点到X点可采取的措施是____________________________。
③有同学计算得到在t1K时,该反应的平衡常数为8.1mol·L-1。你认为正确吗?请说明理由 。
(3)纳米级Cu2O由于具有优良的催化性能而受到关注。在相同的密闭容器中,使用不同方法制得的Cu2O(Ⅰ)和(Ⅱ)分别进行催化CH3OH的脱氢实验:CH3OH(g)![]() HCHO(g)+H2(g)
HCHO(g)+H2(g)
CH3OH的浓度(mol·L-1)随时间t (min)变化如下表:
序号 | 温度 | 0 | 10 | 20 | 30 | 40 | 50 |
① | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
② | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
③ | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
可以判断:实验①的前20 min的平均反应速率 ν(H2)= ;实验温度T1 T2(填“>”、“<”);催化剂的催化效率:实验① 实验②(填“>”、“<”)。
(4)电解法可消除甲醇对水质造成的污染,原理是:通电将Co2+氧化成Co3+,然后Co3+将甲醇氧化成CO2和H+(用石墨烯吸附除去Co2+)。现用如下图所示装置模拟上述过程, 除去甲醇的离子方程式为 。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学-选修3:物质结构与性质】
己知铜的配合物A(结构如下图1)。请回答下列问题:
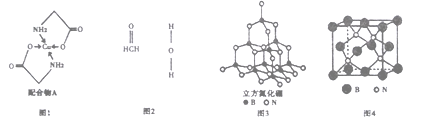
(l)Cu的简化电子排布式为_____________。
(2)A所含三种元素C、N、O的第一电离能由大到小的顺序为_________________。其中氮
原子的杂化轨道类型为_____________________。
(3)配体氨基乙酸根(H2NCH2COO-)受热分解可产生CO2和N2,N2中σ键和π键数目
之比是_____________; N2O与CO2互为等电子体,且N2O分子中O只与一个N相连,则N2O
的电子式为____________________。
(4)在Cu催化下,甲醇可被氧化为甲醛(HCHO),甲醛分子中H-C=O的键角___________1200(选填“大于”、“等于”或“小于”),甲醛能与水形成氢键,请在图2中表示出来___________。
(5)立方氮化硼(如图3)与金刚石结构相似,是超硬材料。立方氮化硼晶体内B-N键数与硼原子数之比为__________;结构化学上用原子坐标参数表示晶胞内部各原子的相对位置,图4立方氮化硼晶胞中,B原子的坐标参数分别有:B(0,0,0);B(1/2,0,1/2);B(1/2,1/2,0)等。则距离上述三个B原子最近且等距的N原子的坐标参数为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为有效控制雾霾,各地积极采取措施改善大气质量。有效控制空气中氮氧化物、碳氧化物和硫氧化物显得尤为重要。
(1)在汽车排气管内安装催化转化器,可将汽车尾气中主要污染物转化为无毒的大气循环物质。
已知:①![]() H=180.5kJ·
H=180.5kJ·![]()
②C和CO的燃烧热(H)分别为-393.5kJ·![]() 和-283kJ·
和-283kJ·![]()
则2NO(g)+2CO(g)=N2(g)+2CO2(g) H=_________kJ·![]()
(2)将0.20molNO和0.10molCO充入一个容积为1L的密闭容器中,反应过程中物质浓度变化如图所示。
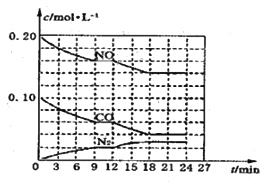
①CO在0—9min内的平均反应速率![]() =__________ mol·L-1·
=__________ mol·L-1·![]() (保留两位有效数字);第12min时改变的反应条件可能为_________。
(保留两位有效数字);第12min时改变的反应条件可能为_________。
A.升高温度 B.加入NO
C.加催化剂 D.降低温度
②该反应在第18min时又达到平衡状态,此时![]() 的体积分数为________(保留三位有效数字),化学平衡常数K=____________(保留两位有效数字)。
的体积分数为________(保留三位有效数字),化学平衡常数K=____________(保留两位有效数字)。
(3)通过人工光合作用能将水与燃煤产生的![]() 转化为HCOOH和
转化为HCOOH和![]() 。已知常温下0.1mol·
。已知常温下0.1mol·![]() 的HCOONa溶液pH=10,则HCOOH的电离常数Ka=__________。
的HCOONa溶液pH=10,则HCOOH的电离常数Ka=__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com