
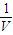
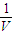 0
0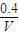
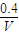
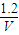
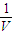
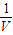 0
0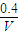
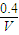
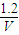
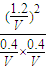 =9,故答案为:9;
=9,故答案为:9;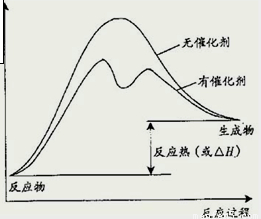 ,
, ;
;

 巧学巧练系列答案
巧学巧练系列答案 课课练江苏系列答案
课课练江苏系列答案科目:高中化学 来源: 题型:
 (2012?广州一模)碳酸甲乙酯(CH3OCOOC2H5)是一种理想的锂电池有机电解液,生成碳酸甲乙酯的原理为:C2H5OCOOC2H5(g)+CH3OCOOCH3(g)?2CH3OCOOC2H5(g)△H1
(2012?广州一模)碳酸甲乙酯(CH3OCOOC2H5)是一种理想的锂电池有机电解液,生成碳酸甲乙酯的原理为:C2H5OCOOC2H5(g)+CH3OCOOCH3(g)?2CH3OCOOC2H5(g)△H1查看答案和解析>>
科目:高中化学 来源: 题型:
 (2013?东城区二模)已知:
(2013?东城区二模)已知: 是碳酸甲乙酯的工业生产原理.如图是投料比[
是碳酸甲乙酯的工业生产原理.如图是投料比[ ]分别为3:1和1:1、反应物的总物质的量相同时,
]分别为3:1和1:1、反应物的总物质的量相同时,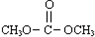 的平衡转化率与温度的关系曲线.下列说法正确的是( )
的平衡转化率与温度的关系曲线.下列说法正确的是( )查看答案和解析>>
科目:高中化学 来源: 题型:
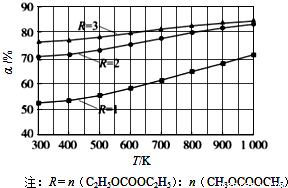
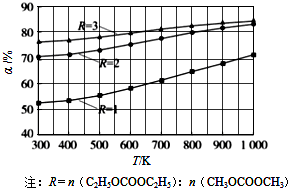
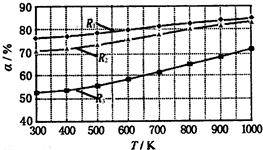 碳酸甲乙酯(CH3OCOOC2H5)是一种理想的锂电池有机电解液.生成碳酸甲乙酯的原理为:C2H5OCOOC2H5(g)+CH3OCOOCH3(g)?2CH3OCOOC2H5(g).其他条件相同,CH3OCOOCH3的平衡转化率(α)与温度(T)、反应物配比( R=n(C2H3OCOOC2H5):n(CH3OCOOCH3 )的关系如图所示.三种反应物配比分别为1:1、2:1、3:1.下列说法不正确的是.( )
碳酸甲乙酯(CH3OCOOC2H5)是一种理想的锂电池有机电解液.生成碳酸甲乙酯的原理为:C2H5OCOOC2H5(g)+CH3OCOOCH3(g)?2CH3OCOOC2H5(g).其他条件相同,CH3OCOOCH3的平衡转化率(α)与温度(T)、反应物配比( R=n(C2H3OCOOC2H5):n(CH3OCOOCH3 )的关系如图所示.三种反应物配比分别为1:1、2:1、3:1.下列说法不正确的是.( )| A、该反应△H>0 | B、R1对应的反应物配比为3:1 | C、650℃,反应物配比为1:1时,平衡常数K=6 | D、当C2H5OCOOC2H5与CH3OCOOC2H5生成速率比为1:2时,反应达到平衡状态 |
查看答案和解析>>
科目:高中化学 来源:2013-2014学年辽宁省高三上学期期中考试理综化学试卷(解析版) 题型:选择题
碳酸甲乙酯(CH3OCOOC2H5)是一种理想的锂电池有机电解液.生成碳酸甲乙酯的原理为:C2H5OCOOC2H5(g)+
CH3OCOOCH3(g)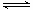 2
CH3OCOOC2H5(g).其他条件相同,CH3OCOOCH3的平衡转化率(α)与温度(T),反应物配比(R=n(C2H5OCOOC2H5):n(CH3OCOOCH3))的关系如下图所示. 三种反应物配比分别为1:1,2:1,3:1.下列说法不正确的是( )
2
CH3OCOOC2H5(g).其他条件相同,CH3OCOOCH3的平衡转化率(α)与温度(T),反应物配比(R=n(C2H5OCOOC2H5):n(CH3OCOOCH3))的关系如下图所示. 三种反应物配比分别为1:1,2:1,3:1.下列说法不正确的是( )
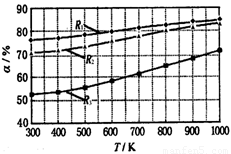
A.该反应△H > 0
B.R1对应的反应物配比为3:1
C.650℃,反应物配比为1:1时,平衡常数K = 6
D.该反应为取代反应
查看答案和解析>>
科目:高中化学 来源:2012-2013学年北京市东城区高三第二学期综合练习(二)化学试卷(解析版) 题型:选择题
已知: 是碳酸甲乙酯的工业生产原理。下图是投料比[
是碳酸甲乙酯的工业生产原理。下图是投料比[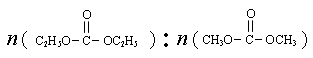 ]分别为3︰1和1︰1、反应物的总物质的量相同时,
]分别为3︰1和1︰1、反应物的总物质的量相同时, 的平衡转化率与温度的关系曲线。下列说法正确的是
的平衡转化率与温度的关系曲线。下列说法正确的是

A.曲线b所对应的投料比为3︰1
B.M点对应的平衡常数小于Q点
C.N点对应的平衡混合气中碳酸甲乙酯的物质的量分数为0.58
D.M点和Q点对应的平衡混合气体的总物质的量之比为2︰1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com