
【题目】对于2 mol O2 下列说法不正确的是( )
A. 含有2NA个氧分子 B. 含有2mol氧原子
C. 质量为64g D. 标况下体积为44.8L
 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案科目:高中化学 来源: 题型:
【题目】配制某补血剂主要成分是硫酸亚铁晶体(FeSO47H2O),为测定该补血剂中铁元素的含量,某化学兴趣小组设计了两套实验方案.方案一:滴定法(用酸性KMnO4溶液滴定),主要步骤如下:
①取一定量补血剂样品,溶解除去不溶物(不损耗铁元素),并配制成250mL待测溶液;
②量取25.00mL待测溶液于锥形瓶中;
③用酸化的0.0100mol/LKMnO4溶液滴定至终点,记录消耗KMnO4溶液体积,重复一到两次实验.
(已知:5Fe 2++MnO4﹣+8H+→5Fe 3++Mn2++4H2O).
(1)250mL待测溶液时需要的玻璃仪器除烧杯、胶头滴管外,还需(填仪器名称);滴定时,左手控制滴定管的活塞,右手摇动锥形瓶,眼睛注视、时,达滴定终点.
(2)上述实验中的KMnO4溶液需要酸化,若分别用下列酸进行酸化,对测定结果的影响是:硝酸 , 硫酸 , 盐酸 . (填“偏大”、“偏小”或“无影响”)
(3)方案二:重量法(将FeSO4转化为Fe2O3 , 测定质量),操作流程如下:
步骤①加入1ml稀硫酸的目的是 .
(4)步骤②是否可以省略 , 理由是 .
(5)步骤④中重复操作加热、冷却、称量,直到为止.
(6)假设实验中铁元素无损耗,则每片补血剂含铁元素的质量g(用含a的代数式表示).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,某稀溶液中由水电离产生的c(OH﹣)=10﹣10 molL﹣1 . 下列有关该溶液的叙述正确的是( )
A.该溶液一定呈酸性
B.该溶液中c(H+)可能等于10﹣5 molL﹣1
C.该溶液的pH可能为4也可能为10
D.该溶液有可能呈中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有五种短周期主族元素,它们在周期表中的位置如图所示,已知R元素的最高正化合价与最低负化合价的代数和为0。
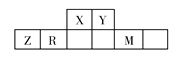
完成下列问题:
(1)Z元素在周期表中的位置是__________________,同周期原子半径最大的元素是____________(填元素符号)。
(2)X的简单氢化物与M的单质,在一定条件下可以发生置换反应,化学方程式为______________,还原产物中含有的化学键类型有____________。
(3)我国发射“神舟”系列飞船的长征火箭,常以X、Y的液态氢化物做燃料。已知X、Y的两种氢化物电子数相等,并且反应时生成两种无毒、无污染的物质。
①写出两种氢化物反应的化学方程式____________________________,反应中氧化剂和还原剂的物质的量之比为____________。
②X的液态氢化物的电子式__________________。
(4)下列说法能证明R、Y非金属性强弱的是____________。
A.R和Y的单质在一定条件下能生成RY2
B.Y单质常温下是气体,R单质是固体
C.Y的氢化物稳定性大于R的氢化物
D.自然界中存在Y单质不存在R单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨是人类科学技术上的一项重大突破,其反应原理为:
N2(g)+3H2(g)2NH3(g)△H=﹣92.4kJmol﹣1
一种工业合成氨的简易流程图如下: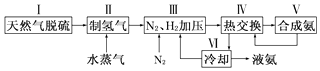
(1)在密闭容器中,使2mol N2和6mol H2混合发生下列反应:N2(g)+3H2(g)2NH3(g)(正反应为放热反应)当反应达到平衡时,N2和H2的浓度比是 . 升高平衡体系的温度(保持体积不变),该反应(填“逆向移动”正向移动”或“不移动”).
(2)氨水、氯水中均存在多种微粒和多个平衡,请写出氯水中存在的一个化学平衡反应的离子方程式 .
(3)步骤Ⅱ中制氢气原理如下:
①CH4(g)+H2O(g)CO(g)+3H2(g)△H=+206.4kJmol﹣1
②CO(g)+H2O(g)CO2(g)+H2(g)△H=﹣41.2kJmol﹣1
对于反应①,一定可以提高平衡体系中H2百分含量,又能加快反应速率的措施是 .
a.升高温度 b.增大压强 c.加入催化剂 d.降低压强
利用反应②,将CO进一步转化,可提高H2产量.若2mol CO和H2的混合气体(H2的体积分数为80%)与H2O反应,得到2.28mol CO、CO2和H2的混合气体,则CO转化率为
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某些含磷洗涤剂含有Na5P3O10,会使水中藻类等浮游生物过量繁殖而造成水体污染。Na5P3O10中磷元素的化合价是( )
A. -2B. +1C. +4D. +5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中可观察到明显现象的是
A. 向盐酸中滴加氢氧化钠溶液
B. 向盐酸中滴加酚酞溶液
C. 向氯化镁溶液中滴加氢氧化钡溶液
D. 将铜丝放入到硫酸铝溶液中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验:
Ⅰ.探究同周期元素性质的递变规律
(1)相同条件下,将钠、镁、铝各1 mol分别投入到足量的同浓度的稀盐酸中,试预测实验结果:_______与稀盐酸反应最剧烈;______与稀盐酸反应产生的气体最多。
(2)向Na2S溶液中通入氯气出现黄色浑浊,可证明Cl的非金属性比S强,反应的离子方程式为_____________________________。
Ⅱ.探究同主族元素非金属性的递变规律
某研究性学习小组设计了一组实验来探究ⅦA族元素原子的得电子能力强弱规律。下图中A、B、C是三个可供选择制取氯气的装置,装置D的玻璃管中①、②处依次放置蘸有NaBr溶液、NaOH浓溶液的棉球。
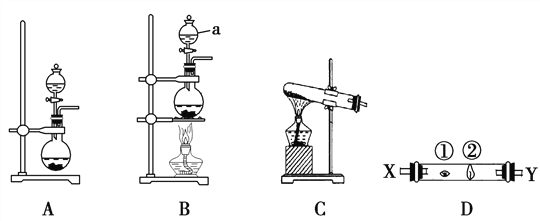
(3)写出装置B中仪器a的名称 ________________。
(4)实验室制取氯气还可采用如下原理:2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O,依据该反应原理选择_____________(填“A”或“B”或“C”)装置制取氯气。
(5)反应装置的导气管连接装置D的X导管,试回答下列问题:
①处发生反应的离子方程式为________________________________;
②处发生反应的离子方程式为________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com