
【题目】我国是干电池的生产和消费大国。某科研团队设计了以下流程对碱性锌锰干电池的废旧资源进行回收利用:
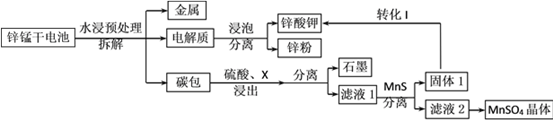
已知:①Ksp(MnS)=2.5×10-13,Ksp(ZnS)=1.6×10-24
②Mn(OH)2开始沉淀时pH为8.3,完全沉淀的pH为9.8
⑴碱性锌锰干电池是以锌粉为负极,二氧化锰为正极,氢氧化钾溶液为电解质。电池总反应为2MnO2+ Zn+2KOH= 2MnOOH+K2ZnO2,请写出电池的正极反应式_____________;
⑵为了提高碳包的浸出效率,可以采取的措施有________________________;(写一条即可)
⑶向滤液1中加入MnS的目的是__________________________________________;
⑷已知MnSO4的溶解度曲线如图所示,从滤液2中析出MnSO4·H2O晶体的操作是蒸发结晶、____________________、洗涤、低温干燥;
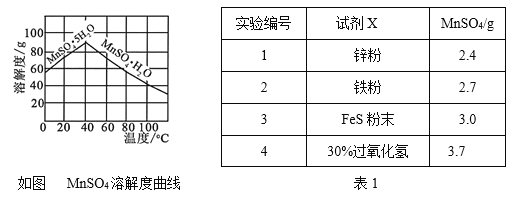
⑸为了选择试剂X,在相同条件下,分别用3 g碳包进行制备MnSO4的实验,得到数据如表1,请写出最佳试剂X与碳包中的主要成分发生反应的化学方程式_____________。
⑹工业上经常采用向滤液2中加入NaHCO3溶液来制备MnCO3,不选择Na2CO3溶液的原因是___________________________________;
⑺该科研小组利用EDTA(乙二胺四乙酸二钠,阴离子简写为Y2-)进行络合滴定测定Mn2+在电池中的百分含量,化学方程式可以表示为Mn2++Y2-=MnY。实验过程如下:
准确称量一节电池的质量平均为24.00g,完全反应后,得到200.00mL滤液2,量取10.00mL滤液2稀释至100.00mL,取20.00mL溶液用0.0500molL-1EDTA标准溶液滴定,平均消耗标准溶液22.00mL,则该方案测得Mn元素的百分含量为________。(保留3位有效数字)
【答案】 MnO2+H2O +e-= MnOOH+OH- 适当的升温(或搅拌) 将溶液中的Zn2+转化为ZnS沉淀而除去 趁热过滤 H2O2+MnO2+H2SO4=MnSO4+2H2O+O2↑ 或
H2O2+ 2MnOOH+2H2SO4=2MnSO4+4H2O+O2↑ Na2CO3溶液的碱性强,容易产生Mn(OH)2的沉淀 25.2%
【解析】⑴锌粉为负极,发生氧化反应,氢氧化钾溶液为电解质时发生的电极反应式为Zn+4OH--2e-= ZnO22-+2H2O,用电池总反应2MnO2+ Zn+2KOH= 2MnOOH+K2ZnO2减去负极电极反应,即得电池的正极反应式为MnO2+H2O +e-= MnOOH+OH-;
⑵通过适当的升温、固体粉碎或搅拌等措施可提高碳包的浸出效率;
⑶滤液1含有Zn2+,遇加入的MnS可以生成ZnS沉淀,再通过过滤即可除去;
⑷有MnSO4的溶解度曲线可知MnSO4·H2O在温度超过40℃后溶解度随温度的升高而降低,则将滤液2溶液蒸发结晶、趁热过滤、洗涤、并低温干燥防分解即可得到MnSO4·H2O晶体;
⑸由表1可知选用30%的过氧化氢获得的MnSO4质量最高,则30%的过氧化氢为最佳试剂,与MnO2在酸性条件下发生反应的化学方程式为H2O2+MnO2+H2SO4=MnSO4+2H2O+O2↑或
H2O2+ 2MnOOH+2H2SO4=2MnSO4+4H2O+O2↑;
⑹相同浓度的NaHCO3溶液和Na2CO3溶液,因CO32-的水解能力强于HCO3-,Na2CO3溶液的碱性强,更容易产生Mn(OH)2的沉淀;
⑺消耗EDTA的物质的量为0.0500molL-1×0.022L=0.0011mol,则样品中Mn2+的物质的量为0.0011mol×![]() =0.11mol,Mn元素的百分含量为
=0.11mol,Mn元素的百分含量为![]() ×100%=25.2%。
×100%=25.2%。


科目:高中化学 来源: 题型:
【题目】氮的氧化物(NOx)是大气污染物之一,工业上在一定温度和催化剂条件下用NH3将NOx还原生成N2。某同学在实验室中对NH3与NOx反应进行了探究。回答下列问题:
(1)氨气的制备

①氨气的发生装置可以选择上图中的_________,反应的化学方程式为_______________。
②欲收集一瓶干燥的氨气,选择上图中的装置,其连接顺序为:发生装置→______(按气流方向,用小写字母表示)。
(2)氨气与二氧化氮的反应
将上述收集到的NH3充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入NO2(两端用夹子K1、K2夹好)。在一定温度下按图示装置进行实验。
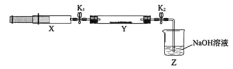
操作步骤 | 实验现象 | 解释原因 |
打开K1,推动注射器活塞,使X中的气体缓慢通入Y管中 | ①Y管中_____________ | ②反应的化学方程式 ____________ |
将注射器活塞退回原处并固定,待装置恢复到室温 | Y管中有少量水珠 | 生成的气态水凝集 |
打开K2 | ③_______________ | ④______________ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据元素周期表和元素周期律分析下面的推断,其中不正确的是( )
A.铍的原子失电子能力比镁弱
B.砹的氢化物不稳定
C.硒化氢比硫化氢稳定
D.氢氧化锶比氢氧化钙的碱性强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列工业产品的生产设计中原子利用率没有达到100%的是
A.合成甲醇:CO + 2H2![]() CH3OH
CH3OH
B.合成乙醛:2CH2=CH2 + O2![]() 2CH3CHO
2CH3CHO
C.合成全降解聚碳酸酯塑料:![]()
D.合成有机玻璃单体-甲基丙烯酸甲酯:
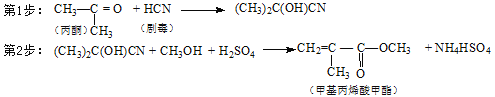
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于炔烃的下列描述正确的是( )
A.分子里含有碳碳三键的不饱和链烃叫炔烃
B.炔烃分子里的所有碳原子都在同一直线上
C.炔烃易发生加成反应,也易发生取代反应
D.炔烃不能使溴水褪色,但可以使高锰酸钾酸性溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,在注射器中加入少量Na2SO3晶体,并吸入少量浓硫酸(以不接触纸条为准).则下列有关说法正确的是

A.蓝色石蕊试纸先变红后褪色
B.NaOH溶液可用于除去实验中多余的SO2
C.湿润淀粉KI试纸未变蓝说明SO2的还原性弱于I2
D.品红试纸、沾有KMnO4溶液滤纸均褪色都能证明SO2的漂白性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com