
 智能训练练测考系列答案
智能训练练测考系列答案 计算高手系列答案
计算高手系列答案科目:高中化学 来源:不详 题型:单选题
| A.1 mol NH5中含有5NA个N—H键(NA表示阿伏加德罗常数) |
| B.NH5中既有共价键又有离子键,它形成的晶体是离子晶体 |
C.NH5的电子式为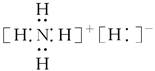 |
| D.它与水反应的化学方程式为:NH5+H2O=NH3·H2O+H2↑ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.浓硝酸和稀硝酸都具有氧化性 |
| B.铜与硝酸的反应属于置换反应 |
| C.金属与HNO3反应一般不产生氢气 |
| D.可用铁或铝制品盛装浓硝酸 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.“碘遇淀粉变蓝色”,“碘”指碘元素 |
| B.为了补碘,要多食用含高碘酸的食物 |
| C.I- 与IO3- 可以大量共存于溶液中 |
| D.通过“取样→灼烧→溶解→过滤→萃取”可从海带中提取单质碘 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

| 实验过程 | 实验现象 |
| I.检验装置的气密性 | |
| II.…… | |
| III.打开分液漏斗活塞,将浓硝酸缓慢滴入烧瓶中,关闭活塞。 | ①中产生大量的红棕色气体,红棕色气体在②中变为无色,气体通过③后依然为无色,通过④后变为红棕色 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
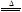 2KNO2+O2↑
2KNO2+O2↑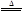 2CuO+4NO2↑+O2↑
2CuO+4NO2↑+O2↑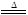 2Ag+2NO2↑+O2↑
2Ag+2NO2↑+O2↑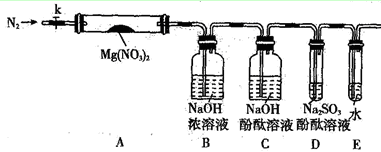
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.36L | B.28L | C.22.4L | D.11.2L |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

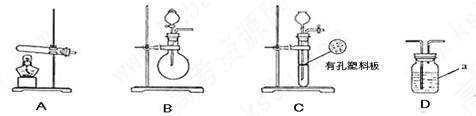
 .氧化铜反应后剩余固体的质量为
.氧化铜反应后剩余固体的质量为 .生成氮气在标准状况下的体积
.生成氮气在标准状况下的体积 。乙小组测得洗气装置D前后的质量和生成氮气在标准状况下的体积。
。乙小组测得洗气装置D前后的质量和生成氮气在标准状况下的体积。 | | 实验装置 | 实验药品 | 制备原理 |
| 甲小组 | A | 氢氧化钙.硫酸铵 | 反应的化学方程式为 ① |
| 乙小组 | ② | 浓氨水.氢氧化钠 | 用化学平衡原理分析氢氧化钠的作用: ③ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com