
 如图所示:
如图所示:

 应用题作业本系列答案
应用题作业本系列答案 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案科目:高中化学 来源: 题型:
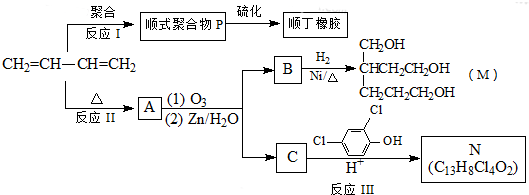
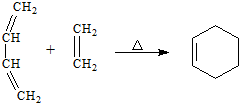
| (1)O3 |
| (2)Zn/H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
 实验室配制480mL 0.1mol?L-1NaOH溶液,回答下列问题
实验室配制480mL 0.1mol?L-1NaOH溶液,回答下列问题查看答案和解析>>
科目:高中化学 来源: 题型:
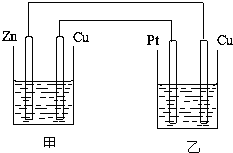 如图所示的装置,甲装置中的电解质溶液为硫酸铜溶液,乙中为稀硫酸,请按以下要求回答问题.
如图所示的装置,甲装置中的电解质溶液为硫酸铜溶液,乙中为稀硫酸,请按以下要求回答问题.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
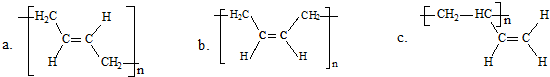
2- 2 |
2+ 2 |
2+ 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 Ⅰ.短周期元素R被称为“生命元素”,R元素的最价高氧化物对应的水化物能与其气态氢化物化合生成盐A,写出生成A的化学方程式
Ⅰ.短周期元素R被称为“生命元素”,R元素的最价高氧化物对应的水化物能与其气态氢化物化合生成盐A,写出生成A的化学方程式查看答案和解析>>
科目:高中化学 来源: 题型:
| A、上述两个反应中反应物的总能量均大于生成物的总能量 |
| B、上述两个反应中反应物的总能量均小于生成物的总能量 |
| C、H2(g)和Cl2(g)反应生成1 mol HCl(g)时放出Q1kJ的热量 |
| D、1molHBr(g)具有的能量大于1molHBr(l)具有的能量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com