
【题目】改变0.1mol·L-1二元弱酸H2A溶液的pH,溶液中的H2A、HA-、A2-的物质的量分数∮(X)随pH的变化如图所示[已知:∮(X)=  ]。下列叙述错误的是( )
]。下列叙述错误的是( )

A. pH=1.2时,c(H2A)=c(HA-) B. lg[K2(H2A)]=-4.2
C. pH=2.7时,c(HA-)>c(H2A)=c(A2-) D. pH=4.2时,c(HA-)=c(A2-)=c(H+)
【答案】D
【解析】由图像可知,pH=1.2时,c(H2A)=c(HA-),pH=2.7时,c(H2A)=c(A2-),pH=4.2时,c(HA-)=c(A2-),随着pH的增大,c(H2A)逐渐减小,c(HA-)先增大后减小,c(A2-)逐渐增大。A.由图像可知pH=1.2时,H2A与HA-的曲线相交,则c(H2A)=c(HA-),故A正确;B.pH=4.2时,c(H+)=10-4.2mol/L,c(HA-)=c(A2-),K2(H2A)=  =10-4.2,则lg[K2(H2A)]=-4.2,故B正确;C.由图像可知,pH=2.7时,c(H2A)=c(A2-),由纵坐标数据可知c(HA-)>c(H2A)=c(A2-),故C正确;D.pH=4.2时,c(HA-)=c(A2-),但此时c(H2A)≈0,如体积不变,则c(HA-)=c(A2-)=0.05molL-1,c(H+)=10-4.2mol/L,如体积变化,则不能确定c(HA-)、c(A2-)与c(H+)浓度大小关系,故D错误;故选D。
=10-4.2,则lg[K2(H2A)]=-4.2,故B正确;C.由图像可知,pH=2.7时,c(H2A)=c(A2-),由纵坐标数据可知c(HA-)>c(H2A)=c(A2-),故C正确;D.pH=4.2时,c(HA-)=c(A2-),但此时c(H2A)≈0,如体积不变,则c(HA-)=c(A2-)=0.05molL-1,c(H+)=10-4.2mol/L,如体积变化,则不能确定c(HA-)、c(A2-)与c(H+)浓度大小关系,故D错误;故选D。


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:
【题目】合理的利用吸收工业产生的废气CO2、NO2、SO2 等可以减少污染,变废为宝。
(1)用CO2可以生产燃料甲醇。
已知:CO2(g)+3H2(g)═CH3OH(g)+H2O(l)△H=﹣akJmol﹣1;
2H2(g)+O2(g)═2H2O(l)△H=﹣b kJmol﹣1;
则表示CH3OH(g)燃烧的热化学方程式为:
_______________________________________________________。
(2)光气(COCl2)是一种重要化工原料,常用于聚酯类材料的生产,工业上通过Cl2(g)+CO(g)COCl2(g)△H < 0制备。图1为实验研究过程中容器内各物质的浓度随时间变化的曲线。回答下列问题:

①0~6min内,反应的平均速率v(Cl2)=_______;
②该反应第一次达平衡时的平衡常数为__________,10min改变的条件是______。
(3)利用氨水可以将SO2和NO2吸收,原理如图2所示:NO2被吸收的离子方程式是___________________________________。

(4)以甲醇燃料电池为电源,粗硅为原料,熔融盐电解法制取硅烷原理如图3,判断A为电源的___极,电解时阳极的电极反应式为_____。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】AJ几种有机物的分子球棍模型或结构简式如图所示,据此回答下列问题:

(1)不能够发生加成反应的烃有__________种,属于芳香族化合物的有_____种。
(2)与E互为同系物的是__________,与G互为同分异构体的是__________。(填字母)
(3)在催化剂作用下,D能与水反应生成乙醛,写出该反应的化学方程式:___________。
(4)上述有机物中有一种能与NaOH溶液反应,请写出该反应的化学方程式:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组用下列装置进行乙醇催化氧化的实验。

(1)在熄灭酒精灯后不断鼓入空气的情况下,反应仍能继续进行,说明该乙醇的氧化反应是________(填“吸热”或“放热”)反应。
(2)甲和乙两水浴的作用不相同。甲的作用是___________;乙的作用是___________。
(3)集气瓶中收集到气体的主要成分是___________________(填化学式)。
(4)若试管a中收集到的液体用紫色石蕊试纸检验,试纸显红色,说明液体中还含有_______。要除去该物质,可先在混合液中加入____(填字母)。
a.水 b.苯 c.碳酸氢钠溶液 d.四氯化碳
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】浓硫酸在下列反应中,既表现出氧化性,又表现出酸性的是
①Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
②C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O
CO2↑+2SO2↑+2H2O
③2FeO+4H2SO4Fe2(SO4)3+SO2↑+4H2O
④Fe2O3+3H2SO4Fe2(SO4)3+3H2O
A. ①② B. ②③
C. ①③ D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①298K时K(HF)=3.5×10-4,Ksp(CaF2)=1.8×10-7
②HF(aq)![]() H+(aq)+F-(aq)△H<0
H+(aq)+F-(aq)△H<0
根据以上已知信息判断下列说法正确的是( )
A. 298K时,加蒸馏水稀释HF溶液, ![]() 保持不变
保持不变
B. 308K时,HF的电离常数Ka>3.5×10-4
C. 298K时,向饱和CaF2溶液中加入少量CaCl2,Ksp(CaF2)会减小
D. 2HF(aq)+Ca2+(aq)![]() CaF2(s)+2H+(aq)K≈0.68
CaF2(s)+2H+(aq)K≈0.68
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用软锰矿浆(软锰矿的主要成分是MnO2,还含有硅、铁、铝、钙、镁和少量重金属镍的化合物等杂质)为原料制取电解锰和四氧化三锰。

注:过量的软锰矿将Fe2+氧化为Fe3+。
(1)纤维素[(C6H10O5)n]还原MnO2时,发生反应的化学方程式为_______。
(2)已知:Kp[Al(OH)3]=1×10-33,Ksp[Fe(OH)3]=3×10-39,加入NH3·H2O后,Al3+浓度为l×10-6mol/L时,溶液中Fe3+浓度为_________
(3)pH对除镍效果的影响如图1:

控制pH为4.5~5.0除镍效果最好,原因是__________
(4)电解MnSO4溶液制备电解锰,用惰性电极电解,阳极的电极反应式为________,为保证电解的顺利进行,电解液必须保持一定的Mn2+浓度。Mn2+浓度和电流效率的关系如图2所示。由图可知当Mn2+浓度大于22g/L时,电流效率随Mn2+浓度增大反而下降,其原因是________。

(5)MnSO4溶液制备四氧化三锰。氨水作沉淀剂,沉淀被空气氧化所得产品的X射线图见图3。
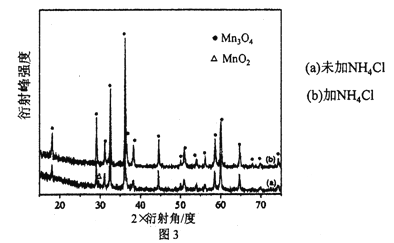
Mn2+形成Mn(OH)2时产生少量Mn2(OH)2SO4,加入NH4Cl会影响Mn2(OH)2SO4的氧化产物,写出NH4Cl存在时,Mn2(OH)2SO4被O2氧化发生反应的离子方程式___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列烃及烃的高聚物:①乙烷;②苯;③聚丙烯;④聚-2-甲基-1,3-丁二烯;⑤2-丁炔;⑥环己烷;⑦邻二甲苯;⑧石油裂解气,能使酸性KMnO4溶液褪色,也能与溴水反应而使溴水褪色的是
A. ②③④⑤⑥⑦⑧ B. ③④⑤⑥⑦⑧ C. ④⑤⑧ D. ④⑤⑦
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com