
【题目】已知反应A2(g)+2B2(g) ![]() 2AB2(g)△H<0,下列说法正确的是( )
2AB2(g)△H<0,下列说法正确的是( )
A.升高温度,正向反应速率增加,逆向反应速率减小
B.升高温度有利于反应速率增加,从而缩短达到平衡的时间
C.达到平衡后,升高温度或增大压强都有利于该反应平衡正向移动
D.达到平衡后,降低温度或减小压强都有利于该反应平衡正向移动
科目:高中化学 来源: 题型:
【题目】下列关于油酯的叙述中不正确的是( )
A. 油酯属于酯类 B. 油酯没有固定的熔、沸点
C. 油酯都不能使溴水褪色 D. 油酯是高级脂肪酸的甘油酯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一隔热系统中,向20.00mL0.01000molL-1的醋酸溶液中逐滴加入0.01000mol.L-1的NaOH溶液,测得混合溶液的温度变化如图。下列相关说法正确的是( )

A. 若a点溶液呈酸性,则a点有:c(CH3COO-)>c(Na+)>c(CH3COOH)
B. 从b到c:  逐渐增大
逐渐增大
C. 水的电离程度:b点<c点
D. b点有0.01000molL-1 + c(H+)= c(Na+)-c(CH3COOH)+ c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验能达到相应目的是( )
选项 | A | B | C | D |
实验 过程 |
|
|
|
|
实验 目的 | 将乙二醇(HOCH2CH2OH)转化为乙二酸(H2C2O4) | 比较氯化铁和二氧化锰对H2O2分解反应的催化效果 | 证明稀硝酸与铜反应时表现出氧化性 | 用SO2与Ba(NO3)2反应获得BaSO3沉淀 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧和钠能够形成化合物F,其晶胞结构如图所示,晶胞参数a=0.566nm,F的化学式为_______;晶胞中氧原子的配位数为________;列式计算晶体F的密度(g·cm-3)________。
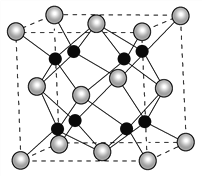
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)1mol HNO3的质量是____________, 1mol HNO3含有_____mol氧原子。
(2)标准状况下11.2L HCl气体溶于水中配成1L溶液,所得盐酸溶液的物质的量浓度是_______________。
(3)2mol OH 约含有__________________个电子。
(4)9.5gMgCl2固体溶于水配成500mL溶液,其中Cl-浓度为________mol· L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常见锌锰干电池因含有汞、酸或碱等,废弃后进入环境将造成严重危害。某化学兴趣小组拟采用如下处理方法回收废电池中的各种资源。

(1)填充物用60℃温水溶解,目的是_________。
(2)铜帽溶解完全后,可采用______方法除去溶液中过量的H2O2。
(3)碱性锌锰干电池的电解质为KOH,总反应为Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2。其正极的电极反应式为______________。
(4)锌锰干电池所含的汞可用KMnO4溶液吸收。在不同pH下,KMnO4溶液对Hg的吸收率及主要产物如下图所示:

根据上图可知:
①pH对Hg吸收率的影响规律是随pH升高,汞的吸收率_______。
②在pH为12~14条件下,KMnO4溶液吸收Hg的化学方程式________。
(5)滤渣的主要成分为含锰混合物,向含锰混合物中加入一定量的稀破酸、稀草酸,并不断搅拌至无气泡为止。主要反应为: 2MnO(OH)+MnO2+2H2C2O4+3H2SO4=3MnSO4+4CO2↑+6H2O。
①当1mol MnO(OH)参加反应时,共有______mol电子发生转移。
②已知:MnCO3和Mn(OH)2的Ksp分别是9×10-11、4×10-14。工业上向上述所得的MnSO4溶液中加入NH3和NH4HCO3来制备碳酸锰, 若溶液中Mn2+为1.0mol·L-1,为尽可能多的获得高纯碳酸锰,应控制溶液中c(CO32-)_______≥mol·L-1,过程中应控制pH<_______。[Mn2+沉淀完全;lg2=0.3]
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com