
| 催化剂 |
| A、所涉及元素中原子半径:C>N>O |
| B、等物质的量N2和CO2中,共价键的个数比为3:4 |
| C、氧化剂与还原剂的物质的量之比为1:1时,NOx中氮元素的化合价为+2价 |
| D、当x=2时,每生成1mol N2,转移电子数为4mol |


科目:高中化学 来源: 题型:
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该电池的正极为锌 |
| B、该电池反应中二氧化锰起催化剂作用 |
| C、电池负极反应式为:Zn+2OH--2e-═ZnO+H2O |
| D、当 0.l mol Zn 完全溶解时,流经电解液的电子个数为1.204×l023 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加入合金的质量不可能为6.4 g |
| B、参加反应的硝酸的物质的量为0.1 mol |
| C、沉淀完全时消耗NaOH溶液的体积为150 mL |
| D、溶解合金时收集到NO气体标准状况下的体积为2.24 L |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
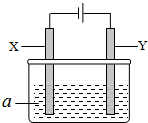 电解原理在化学工业中有广泛应用.如图表示一个电解池,其中a为电解质溶液,X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,其中a为电解质溶液,X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:| 方案 | X | Y | a溶液 |
| A | 银 | 石墨 | AgNO3 |
| B | 银 | 铁 | AgNO3 |
| C | 铁 | 银 | Fe(NO3)3 |
| D | 铁 | 银 | AgNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 高温 |
| 高温 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com