
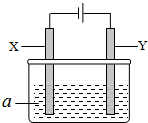
 电解原理在化学工业中有广泛应用.如图表示一个电解池,其中a为电解质溶液,X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,其中a为电解质溶液,X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:| 方案 | X | Y | a溶液 |
| A | 银 | 石墨 | AgNO3 |
| B | 银 | 铁 | AgNO3 |
| C | 铁 | 银 | Fe(NO3)3 |
| D | 铁 | 银 | AgNO3 |
| ||


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
 如图中,图1为甲烷和O2构成的燃料电池,图2为电解MgCl2溶液的装置.用该装置进行实验,反应开始后,观察到x电极附近出现白色沉淀.下列说法正确的是( )
如图中,图1为甲烷和O2构成的燃料电池,图2为电解MgCl2溶液的装置.用该装置进行实验,反应开始后,观察到x电极附近出现白色沉淀.下列说法正确的是( )| A、A处通入的气体为O2,B处通入的气体为CH4 |
| B、电池内部K+向b极移动,OH-向a极移动 |
| C、图1装置中发生的总反应为CH4+2O2═CO2+2H2O |
| D、图1、图2中电解质溶液的pH均增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
| A、所涉及元素中原子半径:C>N>O |
| B、等物质的量N2和CO2中,共价键的个数比为3:4 |
| C、氧化剂与还原剂的物质的量之比为1:1时,NOx中氮元素的化合价为+2价 |
| D、当x=2时,每生成1mol N2,转移电子数为4mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
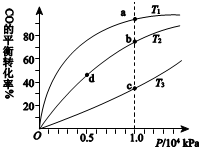 用CO合成甲醇(CH3OH)的化学方程式为CO(g)+2H2(g)?CH3OH(g)△H<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如右下图所示.下列说法正确的是( )
用CO合成甲醇(CH3OH)的化学方程式为CO(g)+2H2(g)?CH3OH(g)△H<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如右下图所示.下列说法正确的是( ) | A.温度: | T1>T2>T3 | |
| B.正反应速率: | υ(b)>υ(d) | υ(a)>υ(c) |
| C.平衡常数: | K(a)>K(c) | K(b)=K(d) |
| D.平均摩尔质量: | M(b)>M(d) | M(a)<M(c) |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 在一定温度下有pH均为2的X、Y、Z三种不同的一元酸各5mL,分别加水稀释到5000mL,其pH与溶液体积(V)的关系如图所示,下列说法正确的是( )
在一定温度下有pH均为2的X、Y、Z三种不同的一元酸各5mL,分别加水稀释到5000mL,其pH与溶液体积(V)的关系如图所示,下列说法正确的是( )| A、若X、Y、Z都是弱酸,则a的值一定小于5 |
| B、三种酸的原来的浓度大小为X>Y>Z |
| C、稀释后X溶液中水的电离程度最小 |
| D、完全中和原X、Y两溶液时,消耗同浓度NaOH的体积 V(X)>V(Y) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、若pH<7时,则一定是c1V1=c2V2 |
| B、该混合液中,c(NH4+)+c(H+)═c(Cl-)+c(OH-) |
| C、当pH=7时,若V1=V2,则一定是c2> c1 |
| D、若V1=V2,c1=c2,则c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1H2和2H2互为同位素,性质相似 |
| B、元素的性质随着原子序数的递增呈周期性变化 |
| C、化学反应遵循质量守恒定律相能量守恒定律 |
| D、溶液、浊液、胶体的本质区别是分散质微粒大小不同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com