
| A、若pH<7时,则一定是c1V1=c2V2 |
| B、该混合液中,c(NH4+)+c(H+)═c(Cl-)+c(OH-) |
| C、当pH=7时,若V1=V2,则一定是c2> c1 |
| D、若V1=V2,c1=c2,则c(Cl-)>c(NH4+)>c(H+)>c(OH-) |


科目:高中化学 来源: 题型:
| A、该电池的正极为锌 |
| B、该电池反应中二氧化锰起催化剂作用 |
| C、电池负极反应式为:Zn+2OH--2e-═ZnO+H2O |
| D、当 0.l mol Zn 完全溶解时,流经电解液的电子个数为1.204×l023 |
查看答案和解析>>
科目:高中化学 来源: 题型:
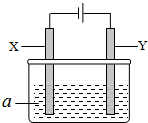 电解原理在化学工业中有广泛应用.如图表示一个电解池,其中a为电解质溶液,X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,其中a为电解质溶液,X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:| 方案 | X | Y | a溶液 |
| A | 银 | 石墨 | AgNO3 |
| B | 银 | 铁 | AgNO3 |
| C | 铁 | 银 | Fe(NO3)3 |
| D | 铁 | 银 | AgNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1 | B、2 | C、3 | D、4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
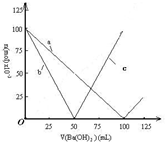 烧杯中盛有100mL 0.1mol/L的NaHSO4溶液,向其中逐滴滴加0.1mol/L的Ba(OH)2溶液,烧杯中某些物质(或微粒)的物质的量的变化曲线如图.下列说法正确的是( )
烧杯中盛有100mL 0.1mol/L的NaHSO4溶液,向其中逐滴滴加0.1mol/L的Ba(OH)2溶液,烧杯中某些物质(或微粒)的物质的量的变化曲线如图.下列说法正确的是( )| A、曲线a表示Ba2+的物质的量的变化 |
| B、曲线c表示OH-的物质的量的变化 |
| C、加入Ba(OH)2溶液50mL反应的离子方程式为Ba2++OH-+H++SO42-→BaSO4↓+H2O |
| D、加入Ba(OH)2溶液大于50mL后,反应的离子方程式为 OH-+H+→H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| A、920 kJ |
| B、557 kJ |
| C、436 kJ |
| D、188 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 高温 |
| 高温 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| A、①和②产物的阴阳离子个数比不相等 |
| B、①和②生成等物质的量的产物,转移电子数相同 |
| C、Na2O2(s)比Na2O(s)稳定 |
| D、1 mol Na2O2(s)与1 mol Na2O(s)所含的能量相差97kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:
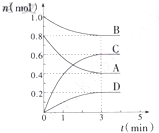 在T℃时,在容积为0.5L的密闭容器中发生如下反应:mA(g)+nB(g)?pC(g)+qD(s),△H<0(m、n、p、q为最简整数比).A、B、C、D物质的量的变化如图所示:
在T℃时,在容积为0.5L的密闭容器中发生如下反应:mA(g)+nB(g)?pC(g)+qD(s),△H<0(m、n、p、q为最简整数比).A、B、C、D物质的量的变化如图所示:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com