
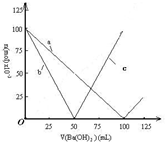
 烧杯中盛有100mL 0.1mol/L的NaHSO4溶液,向其中逐滴滴加0.1mol/L的Ba(OH)2溶液,烧杯中某些物质(或微粒)的物质的量的变化曲线如图.下列说法正确的是( )
烧杯中盛有100mL 0.1mol/L的NaHSO4溶液,向其中逐滴滴加0.1mol/L的Ba(OH)2溶液,烧杯中某些物质(或微粒)的物质的量的变化曲线如图.下列说法正确的是( )| A、曲线a表示Ba2+的物质的量的变化 |
| B、曲线c表示OH-的物质的量的变化 |
| C、加入Ba(OH)2溶液50mL反应的离子方程式为Ba2++OH-+H++SO42-→BaSO4↓+H2O |
| D、加入Ba(OH)2溶液大于50mL后,反应的离子方程式为 OH-+H+→H2O |


科目:高中化学 来源: 题型:
| A、室温下,pH为11的氨水与pH为3的盐酸等体积混合,溶液呈中性 |
| B、在0.1 mol/L(NH4)2Fe(SO4)2溶液中:c(H+)+c(NH4+)+c(Fe2+)═c(OH-)+c(SO42-) |
| C、向醋酸溶液中加入适量醋酸钠,所得酸性溶液中c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| D、0.2mo1?L-1的Na2CO3溶液:c(OH-)═c(HCO3-)+c(H+)+2c(H2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:
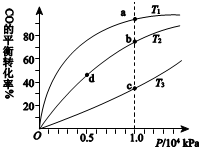 用CO合成甲醇(CH3OH)的化学方程式为CO(g)+2H2(g)?CH3OH(g)△H<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如右下图所示.下列说法正确的是( )
用CO合成甲醇(CH3OH)的化学方程式为CO(g)+2H2(g)?CH3OH(g)△H<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如右下图所示.下列说法正确的是( ) | A.温度: | T1>T2>T3 | |
| B.正反应速率: | υ(b)>υ(d) | υ(a)>υ(c) |
| C.平衡常数: | K(a)>K(c) | K(b)=K(d) |
| D.平均摩尔质量: | M(b)>M(d) | M(a)<M(c) |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
 在一定温度下有pH均为2的X、Y、Z三种不同的一元酸各5mL,分别加水稀释到5000mL,其pH与溶液体积(V)的关系如图所示,下列说法正确的是( )
在一定温度下有pH均为2的X、Y、Z三种不同的一元酸各5mL,分别加水稀释到5000mL,其pH与溶液体积(V)的关系如图所示,下列说法正确的是( )| A、若X、Y、Z都是弱酸,则a的值一定小于5 |
| B、三种酸的原来的浓度大小为X>Y>Z |
| C、稀释后X溶液中水的电离程度最小 |
| D、完全中和原X、Y两溶液时,消耗同浓度NaOH的体积 V(X)>V(Y) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、若pH<7时,则一定是c1V1=c2V2 |
| B、该混合液中,c(NH4+)+c(H+)═c(Cl-)+c(OH-) |
| C、当pH=7时,若V1=V2,则一定是c2> c1 |
| D、若V1=V2,c1=c2,则c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
 1L某混合溶液中可能含有的离子如下表:
1L某混合溶液中可能含有的离子如下表:| 可能大量含有的阳离子 | H+NH4+Al3+K+ |
| 可能大量含有的阴离子 | Cl-Br-I?ClO?AlO2- |
| Cl2的体积 (标准状况) | 2.8L | 5.6L | 11.2L |
| n(Cl-) | 1.25mol | 1.5mol | 2mol |
| n(Br-) | 1.5mol | 1.4mol | 0.9mol |
| n(I-) | a mol | 0 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 充电 |
| 放电 |
| A、充电时,阳极的电极反应式为Li1-xCoO2+xLi+xe-═LiCoO2 |
| B、充电时锂离子由阴极流向阳极 |
| C、放电时,负极的电极反应式为6C+xLi++xe-═Li2C6 |
| D、放电时锂离子由负极流向正极 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、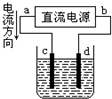 d极发生氧化反应、c极发生还原反应 |
B、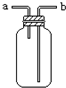 从a口通入气体,可用于收集H2、NH3、NO等气体 |
C、 X若为CCl4,上层为稀硫酸,可用于吸收氨气,并防止倒吸 |
D、 可用于干燥、收集氯化氢,并吸收多余的氯化氢 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com