
| 充电 |
| 放电 |
| A、充电时,阳极的电极反应式为Li1-xCoO2+xLi+xe-═LiCoO2 |
| B、充电时锂离子由阴极流向阳极 |
| C、放电时,负极的电极反应式为6C+xLi++xe-═Li2C6 |
| D、放电时锂离子由负极流向正极 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
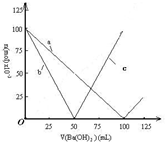 烧杯中盛有100mL 0.1mol/L的NaHSO4溶液,向其中逐滴滴加0.1mol/L的Ba(OH)2溶液,烧杯中某些物质(或微粒)的物质的量的变化曲线如图.下列说法正确的是( )
烧杯中盛有100mL 0.1mol/L的NaHSO4溶液,向其中逐滴滴加0.1mol/L的Ba(OH)2溶液,烧杯中某些物质(或微粒)的物质的量的变化曲线如图.下列说法正确的是( )| A、曲线a表示Ba2+的物质的量的变化 |
| B、曲线c表示OH-的物质的量的变化 |
| C、加入Ba(OH)2溶液50mL反应的离子方程式为Ba2++OH-+H++SO42-→BaSO4↓+H2O |
| D、加入Ba(OH)2溶液大于50mL后,反应的离子方程式为 OH-+H+→H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 高温 |
| 高温 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度/℃ | 700 | 800 | 830 | 1000 | 1200 |
| 化学平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
A、该反应的化学平衡常数表达式为:K=
| ||
| B、该反应为吸热反应 | ||
| C、单位时间内生成B和D的物质的量相等时,该反应处于平衡状态 | ||
| D、其它条件不变时,增大体系的压强,化学平衡常数减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| A、①和②产物的阴阳离子个数比不相等 |
| B、①和②生成等物质的量的产物,转移电子数相同 |
| C、Na2O2(s)比Na2O(s)稳定 |
| D、1 mol Na2O2(s)与1 mol Na2O(s)所含的能量相差97kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:
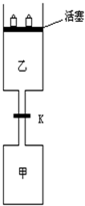 连通装置是化学研究的重要装置起始时,甲、乙体积均为1L,向甲、乙中均充入1.5mol A、3.5mol B,关闭阀门K.在相同温度和有催化剂存在的条件下,两容器中各自发生下列反应:3A(g)+2B(g)?C(g)+2D(g)+200KJ.5分钟时甲达平衡,此时乙容器的体积为0.86L.请回答以下问题:
连通装置是化学研究的重要装置起始时,甲、乙体积均为1L,向甲、乙中均充入1.5mol A、3.5mol B,关闭阀门K.在相同温度和有催化剂存在的条件下,两容器中各自发生下列反应:3A(g)+2B(g)?C(g)+2D(g)+200KJ.5分钟时甲达平衡,此时乙容器的体积为0.86L.请回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、生铁比纯铁更易生锈 |
| B、黄铜(铜锌合金)制作的铜锣不易产生铜绿 |
| C、银质奖章久置后易表面变暗 |
| D、海轮上一般会在吃水线下绑定一定量的锌块 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com