
| 1 |
| 2 |
| A、①和②产物的阴阳离子个数比不相等 |
| B、①和②生成等物质的量的产物,转移电子数相同 |
| C、Na2O2(s)比Na2O(s)稳定 |
| D、1 mol Na2O2(s)与1 mol Na2O(s)所含的能量相差97kJ |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、若pH<7时,则一定是c1V1=c2V2 |
| B、该混合液中,c(NH4+)+c(H+)═c(Cl-)+c(OH-) |
| C、当pH=7时,若V1=V2,则一定是c2> c1 |
| D、若V1=V2,c1=c2,则c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 充电 |
| 放电 |
| A、充电时,阳极的电极反应式为Li1-xCoO2+xLi+xe-═LiCoO2 |
| B、充电时锂离子由阴极流向阳极 |
| C、放电时,负极的电极反应式为6C+xLi++xe-═Li2C6 |
| D、放电时锂离子由负极流向正极 |
查看答案和解析>>
科目:高中化学 来源: 题型:
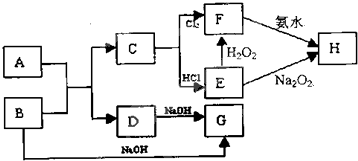
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1H2和2H2互为同位素,性质相似 |
| B、元素的性质随着原子序数的递增呈周期性变化 |
| C、化学反应遵循质量守恒定律相能量守恒定律 |
| D、溶液、浊液、胶体的本质区别是分散质微粒大小不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③ | B、③④⑤ | C、②④ | D、③⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com